题目内容
16.下列实验操作中错误的是( )| A. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 可用酒精萃取碘水中的碘 | |
| D. | 除去淀粉中NaCl杂质,可将混合物加水溶解后,用渗析的方法分离 |
分析 A.分液时应避免液体重新混合而污染;
B.蒸馏时,温度计用于测量馏分的温度;
C.酒精与水混溶;
D.淀粉不能透过半透膜.
解答 解:A.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出,可避免液体重新混合而污染,故A正确;
B.蒸馏时,温度计水银球靠近蒸馏烧瓶支管口,用于测量馏分的温度,故B正确;
C.萃取剂不能溶于水,酒精与水混溶,不能用作萃取剂,故C错误;
D.淀粉不能透过半透膜,可用渗析的方法分离,故D正确.
故选C.
点评 本题考查了萃取、分液、过滤、蒸馏等基本实验操作,过滤适用于不溶性的固体和液体的分离,萃取是利用溶质在互不相溶的溶剂里溶解度不同的分离,蒸馏适用于沸点相差较大的液体混合物的分离,萃取、分液、蒸馏、过滤是物质分离、提纯的常用物理方法.要注意分馏和馏分的区别.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
4.在2014年国家科学技术奖励大会上,甲醇制取低碳烯烃技术(DMTO)获国家技术发明奖一等奖.DMTO主要包括煤的气化、液化、烯烃化三个阶段.
(1)煤的气化:用化学方程式表示出煤的气化的主要反应C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2:
(2)煤的液化:下表中有些反应是煤液化过程中的反应:
①a<0(填“>”、“<”、“=”),c与a、b之间的定量关系为c=a+b.
②K3=2.5,若反应③是在容积为2L的密闭容器巾进行(500℃)的,测得某一时刻体系内H2、CO2、CH3OH、H2O物质的量分别为6mol、2mol、10mol、10mol,则此时CH3OH的生成速率>(填“>”、“<”、“=”) CH3OH的消耗速率.
(3)烯烃化阶段:如图l是某工厂烯烃化阶段产物中乙烯、丙烯的选择性与温度、压强之间的关系(选择性:指生成某物质的百分比,图中I、Ⅱ表示乙烯,Ⅲ表示丙烯).
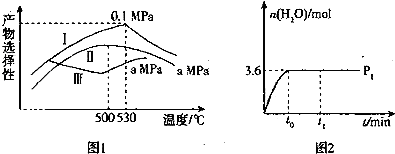
①尽可能多地获得乙烯,控制的生产条件为530℃,0.1Mpa.
②一定温度下某密闭容器中存在反应,2CH3OH(g)?CH2=CH2(g)+2H2O(g)△H>0.在压强为P1时,产物水的物质的量与时间的关系如图2所示,若t0 时刻,测得甲醇的体积分数为10%,此时甲醇乙烯化的转化率为85.7%(保留三位有效数字),若在t1 时刻将容器容积快速扩大到原来的2倍,请在图中绘制出此变化发生后至反应达到新平衡时水的物质的量与时间的关系图.
(1)煤的气化:用化学方程式表示出煤的气化的主要反应C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2:
(2)煤的液化:下表中有些反应是煤液化过程中的反应:
| 热化学方程式 | 平衡常数 | |
| 500℃ | 700℃ | |
| ①2H2(g)+CO(g)?CH3OH(g)△H1=a kJ•mol-1 | 2.5 | 0.2 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g)△H2=b kJ•mol-1 | 1.0 | 2.3 |
| ③3H2(g)+CO2 (g)?CH3OH(g)+H2O(g)△H3=c kJ•mol-1 | K3 | 4.6 |
②K3=2.5,若反应③是在容积为2L的密闭容器巾进行(500℃)的,测得某一时刻体系内H2、CO2、CH3OH、H2O物质的量分别为6mol、2mol、10mol、10mol,则此时CH3OH的生成速率>(填“>”、“<”、“=”) CH3OH的消耗速率.
(3)烯烃化阶段:如图l是某工厂烯烃化阶段产物中乙烯、丙烯的选择性与温度、压强之间的关系(选择性:指生成某物质的百分比,图中I、Ⅱ表示乙烯,Ⅲ表示丙烯).

①尽可能多地获得乙烯,控制的生产条件为530℃,0.1Mpa.
②一定温度下某密闭容器中存在反应,2CH3OH(g)?CH2=CH2(g)+2H2O(g)△H>0.在压强为P1时,产物水的物质的量与时间的关系如图2所示,若t0 时刻,测得甲醇的体积分数为10%,此时甲醇乙烯化的转化率为85.7%(保留三位有效数字),若在t1 时刻将容器容积快速扩大到原来的2倍,请在图中绘制出此变化发生后至反应达到新平衡时水的物质的量与时间的关系图.
11.下列物质中既能跟稀HCl反应,又能跟氢氧化钠溶液反应的是( )
①Al2O3 ②Al(OH)3 ③MgCl2 ④NaHCO3.
①Al2O3 ②Al(OH)3 ③MgCl2 ④NaHCO3.
| A. | ①② | B. | ①②④ | C. | ①③④ | D. | ①②③④ |
8.下列说法正确的是( )
| A. | 泡沫灭火器中用的是硫酸铝和苏打溶液,并且苏打放在小塑料桶里. | |
| B. | 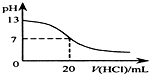 如图表示25℃时,用0.1mol•L-1盐酸滴定20mL0.1mol•L-1NaOH溶液,溶液的pH随加入酸体积的变化 | |
| C. | 在常温下用惰性电极电解足量食盐水的实验中,若电解后溶液总体积为0.5L,阴极析出的气体的分子数为0.5NA,电解后溶液的pH为14 | |
| D. | 常温时,浓度均为0.01mol/L Na2CO3溶液和NaHCO3溶液,等体积混合,其溶液中粒子浓度关系为2c(Na+)=3c(HCO3-)+3c(CO32-)+3c(H2CO3) |
5.用化学方法除去下列物质中的杂质(括号内为杂质),填写所加试剂和有关离子反应方程式.
| 试剂 | 离子反应方程式 | |
| ①Fe(Al) | ||
| ②FeCl 2溶液(FeCl3) |
6.NaH是一种离子化合物,与水反应时生成烧碱和氢气,它也能与乙醇,液氨等反应产生氢气.下列有关NaH的叙述正确的是( )
| A. | 跟水反应时,水作氧化剂 | |
| B. | NaH中阳离子半径大于阴离子半径 | |
| C. | 跟液氨反应时,生成氢气外,还生成铵盐 | |
| D. | 与乙醇反应时,放出氢气的速率比与水反应时更快 |
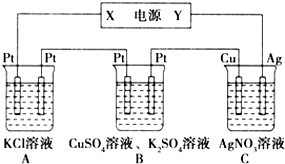 如图所示的装置中,若通入直流电5min时,铜电极质量增加2.16g,试回答:
如图所示的装置中,若通入直流电5min时,铜电极质量增加2.16g,试回答: