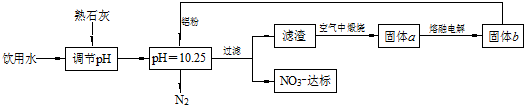
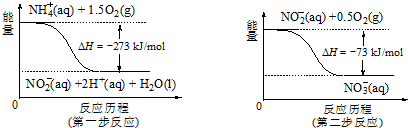题目内容
8.下列说法正确的是( )| A. | 泡沫灭火器中用的是硫酸铝和苏打溶液,并且苏打放在小塑料桶里. | |
| B. | 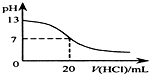 如图表示25℃时,用0.1mol•L-1盐酸滴定20mL0.1mol•L-1NaOH溶液,溶液的pH随加入酸体积的变化 | |
| C. | 在常温下用惰性电极电解足量食盐水的实验中,若电解后溶液总体积为0.5L,阴极析出的气体的分子数为0.5NA,电解后溶液的pH为14 | |
| D. | 常温时,浓度均为0.01mol/L Na2CO3溶液和NaHCO3溶液,等体积混合,其溶液中粒子浓度关系为2c(Na+)=3c(HCO3-)+3c(CO32-)+3c(H2CO3) |
分析 A、泡沫灭火器中用的是小苏打和硫酸铝;
B、酸碱中和的时候pH会突变;
C、阴极被还原得到的是氢气,物质的量是0.5mol,消耗水电离的氢离子1mol,溶液中产生1mol氢氧根离子;
D、溶液中存在物料守恒;碳酸钠和碳酸氢钠溶液中的离子类型相同,碳元素存在物料守恒;
解答 解:A、泡沫灭火器中用的是小苏打和硫酸铝,苏打与硫酸铝发生水解生成碳酸氢钠,不易生成二氧化碳气体,故A错误;
B、用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1NaOH溶液的pH随加入盐酸体积的变化,pH会突变,故B错误;
C、电解饱和食盐水时,阴极析出的是氢气,物质的量是0.5mol,消耗水电离的氢离子1mol,溶液中产生1mol氢氧根离子,由于溶液体积为0.5L,故溶液中的氢氧根的浓度为2mol/L,则氢离子的浓度为5×10-15mol/L,pH为14.3,故C错误;
D、浓度均为0.01mol/L①Na2CO3溶液,②NaHCO3溶液,等体积混合,溶液中存在碳元素守恒,混合前①中$\frac{1}{2}$C(Na+)=C(CO32-)+C(HCO3-)+C(H2CO3);②中C(Na+)=C(CO32-)+C(HCO3-)+C(H2CO3);混合后存在2c(Na+)=3c(HCO3-)+3c(CO32-)+3c(H2CO3),故D正确;
故选D.
点评 本题考查了盐类水解的应用,酸碱中和滴定的变化曲线,电解池中pH的有关计算,溶液中的物料守恒的应用,综合性较大.

练习册系列答案
相关题目
18.NA表示阿伏加德罗常数的值,下列说法中不正确的是( )
| A. | 将3molNH4NO3溶于一定浓度的稀氨水中,溶液呈中性,溶液中一定含有3NA个NH4+ | |
| B. | 标准状况下,含有1mol硫原子的SO2与SO3的混合物,其体积小于22.4L | |
| C. | 10g质量分数为46%的乙醇水溶液中,氢原子的总数为1.2NA | |
| D. | 1L 1mol•L-1的碳酸钠溶液中钠离子的数目小于2NA |
19.关于钠及其化合物正确的是( )
| A. | 某物质的焰色呈黄色,说明该物质一定含有钠元素,不含钾元素 | |
| B. | 氧化钠和过氧化钠和酸均能反应生成盐和水,因此都是碱性氧化物 | |
| C. | 氧化钠和过氧化钠的阴阳离子比前者为1:2,后者为1:1 | |
| D. | 把过氧化钠投入滴有酚酞的水中,溶液先变红后褪色. |
16.下列实验操作中错误的是( )
| A. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 可用酒精萃取碘水中的碘 | |
| D. | 除去淀粉中NaCl杂质,可将混合物加水溶解后,用渗析的方法分离 |
3.下列说法正确的是( )
| A. | 强电解质溶液的导电性一定比弱电解质溶液的导电性强 | |
| B. | 食盐溶液能导电,所以它是电解质 | |
| C. | NaHSO4无论在水溶液里还是在熔融状态下都可以电离出Na+、H+和SO42- | |
| D. | SO3的水溶液可以导电,但它不是电解质 |
13.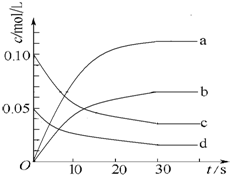 在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)△H<0体系中,n(NO)随时间的变化如下表:
在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)△H<0体系中,n(NO)随时间的变化如下表:
(1)计算该反应在20秒内用O2表示的反应速率v(O2)=0.0015mol•L-1•s-1.
(2)图中表示NO2的变化的曲线是b(填字母).
(3)能说明该反应已达到平衡状态的是b(填字母).
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是c(填字母).
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂.
 在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)△H<0体系中,n(NO)随时间的变化如下表:
在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)△H<0体系中,n(NO)随时间的变化如下表:| 时间/s | 0 | 10 | 20 | 30 | 40 | 50 |
| n(NO)/mol | 0.20 | 0.10 | 0.08 | 0.07 | 0.07 | 0.07 |
(2)图中表示NO2的变化的曲线是b(填字母).
(3)能说明该反应已达到平衡状态的是b(填字母).
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是c(填字母).
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂.
17.常温下,下列离子浓度的关系正确的是( )
| A. | 0.2mol•L-1的CH3COONa溶液中c(CH3COO-)=a mol•L-1,0.1mol•L-1的CH3COONa溶液中c(CH3COO-)=b mol•L-1,则有a=2b | |
| B. | 0.2mol•L-1的CH3COONa溶液与0.1mol•L-1的HCl溶液等体积混合,溶液显酸性:c(Na+)>c(Cl-)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | 相同物质的量浓度的下列溶液中,c(NH4+)由大到小的顺序:(NH4)2SO4>(NH4)2CO3>NH4Cl>NH4HCO3 | |
| D. | 0.1mol•L-1的HCN(弱酸)和0.1mol•L-1的NaCN等体积混合:c(HCN)+c(CN-)+c(OH-)═c(Na+)+c(H+) |
18.下列状态的物质,既能导电又属于电解质的是( )
| A. | MgCl2晶体 | B. | 熔融的KOH | C. | 液态HCl | D. | NaCl溶液 |