题目内容
1.在炼铁时,常采用CaCO3除去矿石中的SiO2.现有SiO2和CaCO3的混合物26g,在高温下加热到质量不再改变,冷却后称质量为17.2g.(1)写出可能发生反应的化学方程式;
(2)求产生的气体在标准状况时的体积;
(3)求原混合物中的SiO2的质量.
分析 (1)碳酸钙高温下分解,且CaO与二氧化硅反应生成硅酸钙;
(2)固体减少的质量为二氧化碳的质量,结合n=$\frac{m}{M}$、V=nVm计算;
(3)结合CaCO3~CO2↑及混合物的质量计算.
解答 解:(1)可能发生反应的化学方程式为CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑、CaO+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3,
答:发生反应为CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑、CaO+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3;
(2)二氧化碳的质量为26g-17.2g=8.8g,标准状况时的体积为$\frac{8.8g}{44g/mol}$×22.4L/mol=4.48L,
答:产生的气体在标准状况时的体积为4.48L;
(3)二氧化碳的质量为8.8g,由C原子守恒可知,碳酸钙的质量为8.8g×$\frac{100}{44}$=20g,则原混合物中的SiO2的质量为26g-10g=6g,
答:原混合物中的SiO2的质量为6g.
点评 本题考查化学反应方程式的计算,为高频考点,把握发生的反应及质量关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
11.下列有关物质的分类或归类正确的是( )
| A. | 化合物:CaCl2、烧碱、聚乙烯、HD | |
| B. | 酸性氧化物:SO2、NO、CO2、Mn2O7 | |
| C. | 胶体:雾、牛奶、豆浆、烟水晶 | |
| D. | 同系物:CH2O2、C2H4O2、C3H6O2、C4H8O2 |
12.室温下,下列有关两种溶液的说法不正确的是( )
| 序号 | ① | ② |
| PH | 12 | 12 |
| 溶液 | 氨水 | 氢氧化钠溶液 |
| A. | 与AlCl3溶液发生反应的离子方程式均为Al3++3OH-═Al(OH)3↓ | |
| B. | ①溶液的物质的量浓度为0.01mol•L-1 | |
| C. | ①②两溶液分别加水稀释10倍,稀释后溶液的pH:①>② | |
| D. | 等体积的①②两溶液分别与0.01mol•L-1的盐酸完全中和,消耗盐酸的体积:①>② |
9.元素X的离子结构示意图为 ,元素Y的原子结构示意图为
,元素Y的原子结构示意图为 ,则元素X与元素Y形成化合物的常见化学式为( )
,则元素X与元素Y形成化合物的常见化学式为( )
 ,元素Y的原子结构示意图为
,元素Y的原子结构示意图为 ,则元素X与元素Y形成化合物的常见化学式为( )
,则元素X与元素Y形成化合物的常见化学式为( )| A. | XY | B. | XY2 | C. | X2Y | D. | XY3 |
16.下列实验操作中错误的是( )
| A. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 可用酒精萃取碘水中的碘 | |
| D. | 除去淀粉中NaCl杂质,可将混合物加水溶解后,用渗析的方法分离 |
13.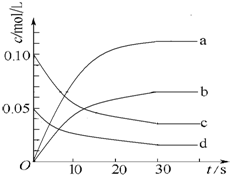 在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)△H<0体系中,n(NO)随时间的变化如下表:
在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)△H<0体系中,n(NO)随时间的变化如下表:
(1)计算该反应在20秒内用O2表示的反应速率v(O2)=0.0015mol•L-1•s-1.
(2)图中表示NO2的变化的曲线是b(填字母).
(3)能说明该反应已达到平衡状态的是b(填字母).
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是c(填字母).
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂.
 在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)△H<0体系中,n(NO)随时间的变化如下表:
在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)△H<0体系中,n(NO)随时间的变化如下表:| 时间/s | 0 | 10 | 20 | 30 | 40 | 50 |
| n(NO)/mol | 0.20 | 0.10 | 0.08 | 0.07 | 0.07 | 0.07 |
(2)图中表示NO2的变化的曲线是b(填字母).
(3)能说明该反应已达到平衡状态的是b(填字母).
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是c(填字母).
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂.
10.下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A. | 某弱酸的酸式盐NaHA溶液中一定有:c(OH-)+2c(A2-)═c(H+)+c(H2A) | |
| B. | 0.1 mol•L-1CH3COONa 溶液与0.05 mol•L-1盐酸等体积混合后的酸性溶 液中:c(CH3COO-)>c(CH3COOH)>c(Cl-)=c(H+) | |
| C. | 物质的量浓度相等的HCN溶液和NaCN溶液等体积混合后的溶液中:c(CN-)+c(OH-)═c(H+)+c(Na+) | |
| D. | 0.1 mol•L-1(NH4)2Fe(SO4)2溶液中:c(NH4+)+c(NH3•H2O)+c(Fe2+)=0.3 mol•L-1 |
11.下列说法正确的是( )
| A. | 对于△S>0的反应,若在任何温度下均能自发进行,则该反应△H>0 | |
| B. | 氢氧燃料电池发电,比氢气直接在空气中燃烧发电能量转换率高 | |
| C. | 合成氨反应N2(g)+3H2(g)?2NH3(g)△H<0,加入催化剂能加快反应速率并提高转化率 | |
| D. | Na2S2O3溶液中加入稀盐酸:2S2O32-+2H+═SO42-+3S↓+H2O |