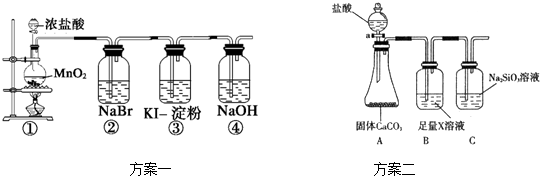
题目内容
近几年我国某些城市酸雨污染较为严重,主要是因为大量燃烧含硫量高的煤而形成的.
【实验目的】通过实验证明煤中含有碳元素和硫元素.
【查阅资料】
(1)“二氧化硫能使高锰酸钾溶液褪色(由紫红色变为无色),请完成该反应的离子方程式:
SO2+ MnO4-+ = + Mn2++
根据上述资料,甲同学和丙同学分别设计实验方案进行探究.
【实验探究】甲同学:甲同学进行了如图一所示A、B两步实验:
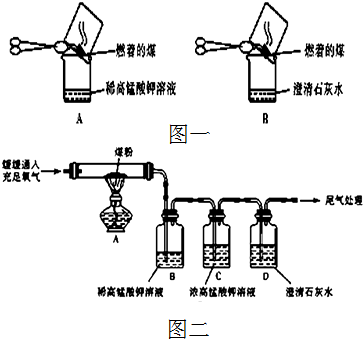
“实验现象”:A中稀高锰酸钾溶液褪色,B中澄清石灰水变浑浊.
“得出结论”:煤燃烧生成二氧化硫和二氧化碳,证明煤中含有碳元素和硫元素.
(2)乙同学认为甲的方案不合理,其理由是:
【实验探究】丙同学:丙同学进行了如图二所示实验(部分装置在图中略去):
(3)上图C装置的作用是
(4)证明煤中含有碳元素和硫元素的现象是:
(5)装置C中的高锰酸钾溶液也可以替换为
A.足量I2的淀粉溶液 B.足量饱和NaHCO3溶液 C.足量Na2SO3溶液 D.足量溴水.
【实验目的】通过实验证明煤中含有碳元素和硫元素.
【查阅资料】
(1)“二氧化硫能使高锰酸钾溶液褪色(由紫红色变为无色),请完成该反应的离子方程式:
根据上述资料,甲同学和丙同学分别设计实验方案进行探究.
【实验探究】甲同学:甲同学进行了如图一所示A、B两步实验:

“实验现象”:A中稀高锰酸钾溶液褪色,B中澄清石灰水变浑浊.
“得出结论”:煤燃烧生成二氧化硫和二氧化碳,证明煤中含有碳元素和硫元素.
(2)乙同学认为甲的方案不合理,其理由是:
【实验探究】丙同学:丙同学进行了如图二所示实验(部分装置在图中略去):
(3)上图C装置的作用是
(4)证明煤中含有碳元素和硫元素的现象是:
(5)装置C中的高锰酸钾溶液也可以替换为
A.足量I2的淀粉溶液 B.足量饱和NaHCO3溶液 C.足量Na2SO3溶液 D.足量溴水.
考点:性质实验方案的设计
专题:实验设计题
分析:(1)根据元素化合价的变化结合电子守恒和元素守恒知识来配平;
(2)根据二氧化硫和二氧化碳都是酸性氧化物,均可以和氢氧化钙之间发生反应;
(3)根据二氧化硫和二氧化碳都是酸性氧化物,均可以和氢氧化钙之间发生反应的性质结合物质检验的试剂来回答;
(4)二氧化硫和二氧化碳都是酸性氧化物,均可以和氢氧化钙之间发生反应的性质,要先验证二氧化硫再除去二氧化硫再验证二氧化碳;
(5)高锰酸钾的作用是除去二氧化硫并检验是否除尽,故加入氧化剂把二氧化硫氧化且有明显的颜色变化.
(2)根据二氧化硫和二氧化碳都是酸性氧化物,均可以和氢氧化钙之间发生反应;
(3)根据二氧化硫和二氧化碳都是酸性氧化物,均可以和氢氧化钙之间发生反应的性质结合物质检验的试剂来回答;
(4)二氧化硫和二氧化碳都是酸性氧化物,均可以和氢氧化钙之间发生反应的性质,要先验证二氧化硫再除去二氧化硫再验证二氧化碳;
(5)高锰酸钾的作用是除去二氧化硫并检验是否除尽,故加入氧化剂把二氧化硫氧化且有明显的颜色变化.
解答:
解:(1)高锰酸钾具有强氧化性,把二氧化硫氧化成硫酸,本身被二氧化硫还原成锰离子,故缺项为水、硫酸根离子和氢离子;
二氧化硫的化合价从+4升高到+6,升高了2价,高锰酸钾中锰元素化合价从+7降到+2,下降了5价,所以二氧化硫前边系数是5,高锰酸根系数是2,锰离子系数是2,硫酸根系数是5,根据原子守恒得到化学反应系数即可,故答案为:( 5 )SO2+( 2 )MnO4-+( 2 )H2O=( 5 )SO
+( 2 )Mn2++( 4 )H+;
(2)由二氧化硫和二氧化碳一样,也能使澄清石灰水变浑浊,所以检验二氧化碳之前先检验二氧化硫,再将之除尽,最后检验二氧化碳,
故答案为:二氧化硫也能使澄清的石灰水变混浊,无法证明煤中含有碳元素;
(3)由二氧化硫和二氧化碳一样,也能使澄清石灰水变浑浊,所以检验二氧化碳之前先检验二氧化硫,再将之除尽,
故答案为:除去SO2并检验其是否除尽;
(4)二氧化硫的检验用品红,二氧化硫会使之褪色,二氧化碳检验用澄清石灰水,检验二氧化碳之前先检验二氧化硫,再将之除尽,最后检验二氧化碳,二氧化碳能使石灰水变浑浊,故答案为:B中溶液褪色,C中溶液不褪色,D中溶液变浑浊.
(5)高锰酸钾的作用是除去二氧化硫并检验是否除尽,故加入氧化剂把二氧化硫氧化且有明显的颜色变化,
A.足量I2的淀粉溶液,碘可把二氧化硫氧化除去,单质碘遇淀粉变蓝,故若溶液呈蓝色证明二氧化硫已除尽,A符合;
B.足量饱和NaHCO3溶液,没有氧化性,不能把二氧化硫氧化,故B不符合;
C.足量Na2SO3溶液具有还原性,不能把二氧化硫氧化,故C不符合;
D.足量溴水,溴具有强氧化性,可把二氧化硫氧化颜色变浅,表明已除尽,故D符合;
故选AD.
二氧化硫的化合价从+4升高到+6,升高了2价,高锰酸钾中锰元素化合价从+7降到+2,下降了5价,所以二氧化硫前边系数是5,高锰酸根系数是2,锰离子系数是2,硫酸根系数是5,根据原子守恒得到化学反应系数即可,故答案为:( 5 )SO2+( 2 )MnO4-+( 2 )H2O=( 5 )SO
2- 4 |
(2)由二氧化硫和二氧化碳一样,也能使澄清石灰水变浑浊,所以检验二氧化碳之前先检验二氧化硫,再将之除尽,最后检验二氧化碳,
故答案为:二氧化硫也能使澄清的石灰水变混浊,无法证明煤中含有碳元素;
(3)由二氧化硫和二氧化碳一样,也能使澄清石灰水变浑浊,所以检验二氧化碳之前先检验二氧化硫,再将之除尽,
故答案为:除去SO2并检验其是否除尽;
(4)二氧化硫的检验用品红,二氧化硫会使之褪色,二氧化碳检验用澄清石灰水,检验二氧化碳之前先检验二氧化硫,再将之除尽,最后检验二氧化碳,二氧化碳能使石灰水变浑浊,故答案为:B中溶液褪色,C中溶液不褪色,D中溶液变浑浊.
(5)高锰酸钾的作用是除去二氧化硫并检验是否除尽,故加入氧化剂把二氧化硫氧化且有明显的颜色变化,
A.足量I2的淀粉溶液,碘可把二氧化硫氧化除去,单质碘遇淀粉变蓝,故若溶液呈蓝色证明二氧化硫已除尽,A符合;
B.足量饱和NaHCO3溶液,没有氧化性,不能把二氧化硫氧化,故B不符合;
C.足量Na2SO3溶液具有还原性,不能把二氧化硫氧化,故C不符合;
D.足量溴水,溴具有强氧化性,可把二氧化硫氧化颜色变浅,表明已除尽,故D符合;
故选AD.
点评:本题考查了二氧化硫的性质实验设计,中等难度.明确检验二氧化碳应排除二氧化硫的干扰是解题关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
把下列四种 X 溶液分别加入四个盛有 10mL2mol?L-1盐酸的烧杯中,均匀加水稀释到50mL.此时X 和盐酸进行反应.其中反应速率最大的是( )
| A、40mL 1.5 mol?L-1的 X 溶液 |
| B、20mL 2 mol?L-1的 X 溶液 |
| C、10mL 4 mol?L-1的 X 溶液 |
| D、l0mL 2 mol?L-1的 X 溶液 |
使用酸碱中和滴定的方法,用0.1000mo1?L-1盐酸滴定锥形瓶中未知浓度的NaOH溶液,下列操作会使测定结果偏低的是( )
| A、用酸式滴定管量取0.1000 mol?L-1盐酸时,酸式滴定管经蒸馏水洗净后未用0.1000mo1?L-1盐酸润洗 |
| B、滴定前平视读数,滴定结束时俯视读数 |
| C、滴定前滴定管下端尖嘴没有气泡,滴定后读数时发现滴定管下端尖嘴有气泡 |
| D、用未知浓度的Na0H待测液润洗锥形瓶 |
除去下列溶液中的杂质(括号内是杂质)所用试剂不正确的是( )
| A、KOH溶液[K2CO3]:用Ca(OH)2溶液 |
| B、NaOH溶液[Ba(OH)2]:用Na2SO4溶液 |
| C、NaCl溶液[Na2SO4]:用Ba(NO3)2溶液 |
| D、HNO3溶液[HCl]:用AgNO3溶液 |
在0.1mol?L-1的NaHCO3溶液中,下列关系式正确的是( )
| A、c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-) |
| B、c(Na+)>c(CO32->c(HCO3-)>c(OH-) |
| C、c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2 c(CO32-) |
| D、c(HCO3-)+c(CO32-)=0.1 mol?L-1 |