题目内容
把下列四种 X 溶液分别加入四个盛有 10mL2mol?L-1盐酸的烧杯中,均匀加水稀释到50mL.此时X 和盐酸进行反应.其中反应速率最大的是( )
| A、40mL 1.5 mol?L-1的 X 溶液 |
| B、20mL 2 mol?L-1的 X 溶液 |
| C、10mL 4 mol?L-1的 X 溶液 |
| D、l0mL 2 mol?L-1的 X 溶液 |
考点:化学反应速率的影响因素
专题:
分析:先计算出稀释后X溶液的中X的物质的量,最后溶液的体积都为50mL,则物质的量越大,浓度越大,则反应速率越大来判断.
解答:
解:均加水稀释到50mL,
A.n(X)=0.04L×1.5mol/L=0.06mol;
B.n(X)=0.02L×2mol/L=0.04mol;
C.n(X)=0.01L×4mol/L=0.04mol;
D.n(X)=0.01L×2mol/L=0.02mol,
物质的量最大的是A,则A浓度最大,反应速率最大.
故选A.
A.n(X)=0.04L×1.5mol/L=0.06mol;
B.n(X)=0.02L×2mol/L=0.04mol;
C.n(X)=0.01L×4mol/L=0.04mol;
D.n(X)=0.01L×2mol/L=0.02mol,
物质的量最大的是A,则A浓度最大,反应速率最大.
故选A.
点评:本题考查反应速率与浓度的关系及物质的量的计算,难度不大,明确影响化学反应速率的因素、物质的量与浓度的关系是解答本题的关键.

练习册系列答案
相关题目
根据表数据,下列判断正确的是( )
| 电离常数(25℃) |
| HF: Ka1=3.6×10-4 |
| H3PO4: Ka1=7.5×10-3 Ka2=6.2×10-8 Ka3=2.2×10-13 |
| A、在等浓度的NaF、NaH2PO4混合溶液中,c(Na+)+c(H+)=c(F-)+c(H2PO4-)+c(OH-) |
| B、少量H3PO4和NaF反应的离子方程式为:H3PO4+F-→H2PO4-+HF |
| C、同温同浓度时,溶液的pH:NaF>NaH2PO4>Na2HPO4 |
| D、结合H+的能力:PO43->F->HPO42- |
类推是化学学习中的常用方法,但类推的结论最终要经过实践的检验才能证明其正确与否.下列类推结论中正确的是( )
| A、第Ⅳ族氢化物沸点:CH4<SiH4,则第Ⅴ族氢化物沸点:NH3<PH3 |
| B、第二周期元素氢化物稳定性顺序是HF>H2O>NH3,则第三周期元素氢化物稳定性顺序也是HCl>H2S>PH3 |
| C、可电解熔融氯化镁制取金属镁,则也能用电解熔融氯化铝制取金属铝 |
| D、晶体中有阴离子,必有阳离子,则晶体中有阳离子,也必有阴离子 |
中学常见物质A、B、C、D、E、X,存在图转化关系(部分生成物和反应条件略去).下列推断不正确的是( )A
B
C
D.
| E |
| E |
| X |
| A、若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B或C |
| B、若D是一种强碱,则A、B、C均可与X反应生成D |
| C、若D为NaCl,且A可与C反应生成B,则E可能是CO2 |
| D、若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁 |
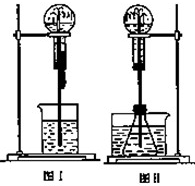 喷泉是一种常见的实验现象(如图),其产生原因是存在压强差.
喷泉是一种常见的实验现象(如图),其产生原因是存在压强差.