题目内容
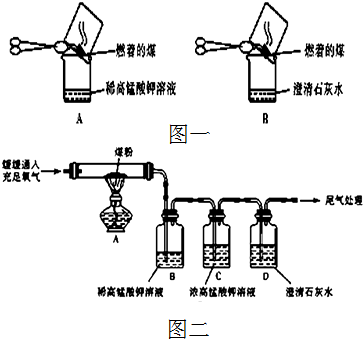
某化学课外活动小组为了验证元素非金属性递变规律,设计了如下图所示的两套实验方案进行实验探究:
(1)根据方案一装置回答以下问题:
Ⅰ写出装置①发生的化学反应方程式: .
Ⅱ若将反应后②中的溶液倒入CCl4中,出现的现象与右图吻合的是 .(填代号)
Ⅲ装置③中的现象是 .
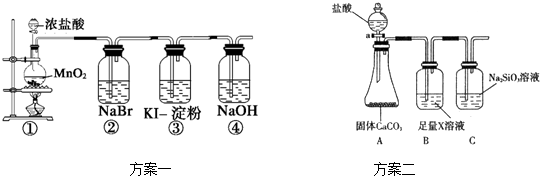
(2)根据方案二装置回答以下问题:
Ⅰ方案二验证元素非金属性递变的理论依据是: .
ⅡB装置的作用是 ,X是 .
Ⅲ能说明碳元素和硅元素非金属性强弱的实验现象是 .
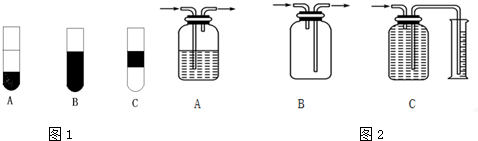
(3)方案一、二中多次用到广口瓶,在化学实验中广口瓶可以配合玻璃管和其他简单仪器组成各种功能的装置,被称为气体实验的“万能瓶”分析下列广口瓶组合装置的用途;
A ; B ; C .

(1)根据方案一装置回答以下问题:
Ⅰ写出装置①发生的化学反应方程式:
Ⅱ若将反应后②中的溶液倒入CCl4中,出现的现象与右图吻合的是
Ⅲ装置③中的现象是

(2)根据方案二装置回答以下问题:
Ⅰ方案二验证元素非金属性递变的理论依据是:
ⅡB装置的作用是
Ⅲ能说明碳元素和硅元素非金属性强弱的实验现象是
(3)方案一、二中多次用到广口瓶,在化学实验中广口瓶可以配合玻璃管和其他简单仪器组成各种功能的装置,被称为气体实验的“万能瓶”分析下列广口瓶组合装置的用途;
A
考点:性质实验方案的设计
专题:实验设计题
分析:(1)二氧化锰和浓盐酸加热生成二氯化锰和氯气;氯气的氧化性强于溴,故把氯气通入②中,氯气把溴离子氧化成单质溴,单质溴易溶于四氯化碳中,四氯化碳密度比水大,据此分析现象;氯气把碘离子置换成单质碘,碘遇淀粉变蓝;
(2)根据信息知道:方案二根据元素非金属性与对应最高价含氧酸之间的关系完成C、Si两种非金属元素的非金属性强弱比较,根据强酸制弱酸来回答即可;
Ⅱ氯化氢易挥发,故B装置的作用是除去挥发的氯化氢,可用饱和碳酸氢钠溶液;
Ⅲ碳酸酸性强于硅酸,硅酸为不溶性沉淀;
(3)根据装置特点和所盛试剂分析所起作用.
(2)根据信息知道:方案二根据元素非金属性与对应最高价含氧酸之间的关系完成C、Si两种非金属元素的非金属性强弱比较,根据强酸制弱酸来回答即可;
Ⅱ氯化氢易挥发,故B装置的作用是除去挥发的氯化氢,可用饱和碳酸氢钠溶液;
Ⅲ碳酸酸性强于硅酸,硅酸为不溶性沉淀;
(3)根据装置特点和所盛试剂分析所起作用.
解答:
解:(1)二氧化锰和浓盐酸加热生成二氯化锰和氯气,反应方程式为:MnO2+4HCl(浓)
Cl2↑+MnCl2+2H2O;
氯气的氧化性强于溴,故把氯气通入②中,氯气把溴离子氧化成单质溴,Cl2+2Br-=Br2+2Cl-,单质溴易溶于四氯化碳中,四氯化碳密度比水大,故碘的四氯化碳在下层,出现的现象与右图吻合的是A;
氯气把碘离子置换成单质碘,Cl2+I-=I2+2Cl-,碘遇淀粉变蓝,故看到的现象为溶液变蓝色;
故答案为:MnO2+4HCl(浓)
Cl2↑+MnCl2+2H2O;A;溶液变蓝色;
(2)Ⅰ根据题干信息:方案二根据元素非金属性与对应最高价含氧酸之间的关系,设计了同主族元素非金属性强弱比较的实验研究,碳酸酸性强于硅酸,最高价氧化物对应水化物酸性越强,则原子的非金属性越强,依据强酸制弱酸来设计反应,
故答案为:①元素的非金属性越强,最高价氧化物对应水化物的酸性越强.
②酸和盐反应生成新酸和新盐,则反应物的酸比生成物的酸的酸性强(以强制弱);
Ⅱ氯化氢易挥发,故B装置的作用是除去挥发的氯化氢,可用饱和碳酸氢钠溶液;
故答案为:吸收CO2中的HCl;饱和NaHCO3溶液;
ⅢC中盛装硅酸钠溶液,由于碳酸酸性比硅酸强,在C中通入二氧化碳气体生成硅酸沉淀,反应的离子方程式为CO2+SiO32-+H2O=H2SiO3↓+CO32-,
故答案为:C中有白色沉淀产生;
(3)A长进短出,属于洗气装置,B没有试剂,短进长出,属于向下排空气法收集气体,C广口瓶和量筒相连属于量气装置;
故答案为:A洗气; B 收集密度比空气小的气体; C测量气体体积.
| ||
氯气的氧化性强于溴,故把氯气通入②中,氯气把溴离子氧化成单质溴,Cl2+2Br-=Br2+2Cl-,单质溴易溶于四氯化碳中,四氯化碳密度比水大,故碘的四氯化碳在下层,出现的现象与右图吻合的是A;
氯气把碘离子置换成单质碘,Cl2+I-=I2+2Cl-,碘遇淀粉变蓝,故看到的现象为溶液变蓝色;
故答案为:MnO2+4HCl(浓)
| ||
(2)Ⅰ根据题干信息:方案二根据元素非金属性与对应最高价含氧酸之间的关系,设计了同主族元素非金属性强弱比较的实验研究,碳酸酸性强于硅酸,最高价氧化物对应水化物酸性越强,则原子的非金属性越强,依据强酸制弱酸来设计反应,
故答案为:①元素的非金属性越强,最高价氧化物对应水化物的酸性越强.
②酸和盐反应生成新酸和新盐,则反应物的酸比生成物的酸的酸性强(以强制弱);
Ⅱ氯化氢易挥发,故B装置的作用是除去挥发的氯化氢,可用饱和碳酸氢钠溶液;
故答案为:吸收CO2中的HCl;饱和NaHCO3溶液;
ⅢC中盛装硅酸钠溶液,由于碳酸酸性比硅酸强,在C中通入二氧化碳气体生成硅酸沉淀,反应的离子方程式为CO2+SiO32-+H2O=H2SiO3↓+CO32-,
故答案为:C中有白色沉淀产生;
(3)A长进短出,属于洗气装置,B没有试剂,短进长出,属于向下排空气法收集气体,C广口瓶和量筒相连属于量气装置;
故答案为:A洗气; B 收集密度比空气小的气体; C测量气体体积.
点评:本题考查非金属性强弱比较的实验设计,题目难度不大,注意实验设计的原理和方法.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
下列物质属于强电解质的是( )
| A、H2CO3 |
| B、Cl2 |
| C、CaCO3 |
| D、NH3 |
能正确表示下列化学反应的离子方程式是( )
| A、过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O |
| B、硫酸镁溶液跟氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓ |
| C、NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-=NH3↑+H2O |
| D、向碳酸氢钠溶液中滴加少量稀硝酸:CO32-+2H +=CO2↑ +H2O |
用蒸馏水稀释0.1mol/L醋酸时,始终保持增大趋势的是( )
| A、溶液中的c(CH3COO-) |
| B、溶液中的c(H+) |
| C、醋酸的电离平衡常数 |
| D、溶液中的c(OH-) |
西维因是一种高效低毒杀虫剂,在碱性条件下可水解:则下列说法正确的是( )
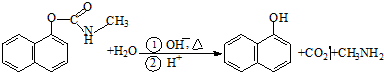

| A、西维因是一种芳香烃 |
| B、西维因分子中所有碳原子一定共面 |
| C、可用FeCl3溶液检验西维因是否发生水解 |
| D、在Ni催化下1mol西维因最多能与6molH2加成 |