题目内容
17.CuCl2、CuCl是重要的化工原料,广泛地用作有机合成催化剂.实验室中以粗铜(含杂质Fe)为原料,一种制备铜的氯化物的流程如图: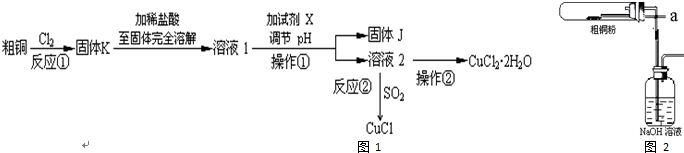
请回答下列问题:
(1)如图装置进行反应①,导管a通入氯气
(夹持仪器和加热装置省略).观察到的现象是试管内有棕色烟产生,写出铜与氯气反应的化学方程式Cu+Cl2$\frac{\underline{\;点燃\;}}{\;}$CuCl2.
(2)上述流程中固体K溶于稀盐酸的目的是避免Cu2+水解.试剂X、固体J的物质分别为c.
a.NaOH Fe(OH)3 b.NH3•H2O Fe(OH)2 c.CuO Fe(OH)3 d.CuSO4 Cu(OH)2
(3)反应②是向溶液2中通入一定量的SO2,加热一段时间后生成CuCl白色沉淀.写出制备CuCl的离子方程式2Cu2++2Cl-+SO2+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+4H++SO42-.
(4)反应后,如图盛有NaOH溶液的广口瓶中溶液具有漂白、消毒作用,若用钢铁(含Fe、C)制品盛装该溶液会发生电化学腐蚀,钢铁制品表面生成红褐色沉淀,溶液会失去漂白、杀菌消毒功效.该红褐色沉淀的主要化学式是Fe(OH)3.该腐蚀过程的正极反应式为ClO-+2e-+H2O=Cl-+2OH-.
(5)以石墨为电极,电解CuCl2溶液时发现阴极上也会有部分CuCl析出,写出此过程中阴极上的电极反应式Cu2++e-+Cl-=CuCl.
分析 粗铜(含杂质Fe)与氯气反应生成氯化铁和氯化铜,加稀盐酸溶解,形成氯化铁和氯化铜溶液,同时抑制氯化铜、氯化铁水解,溶液1中加入X调节溶液pH,得到溶液乙,经过系列操作得到CuCl2•2H2O,故溶液2为CuCl2溶液,则调节pH目的是使溶液中铁离子转化为Fe(OH)3沉淀,过滤除去,试剂X可以为CuO、氢氧化铜等,结合题目信息可知,氯化铜溶液,加少量盐酸,抑制氯化铜水解,再蒸发浓缩、冷却结晶得到CuCl2•2H2O,再经过过滤、洗涤、干燥得到纯净的晶体.
(1)铜在氯气中燃烧产生棕色氯化铜烟;
(2)氯化铜、氯化铁在溶液中会发生水解,铜盐水解生成氢氧化铜,保持溶液呈强酸性,避免铜离子水解损失,调节pH目的是使溶液中铁离子转化为Fe(OH)3沉淀;
(3)铜离子是氧化剂,SO2是还原剂,生成CuCl和SO42-;
(4)氢氧化钠溶液吸收氯气,生成有次氯酸钠,生铁在次氯酸钠和氢氧化钠的混合溶液中发生电化学腐蚀,碳等杂质为正极,铁为负极,正极发生还原反应,负极发生氧化反应,红褐色沉淀为氢氧化铁,正极上ClO-得电子生成Cl-;
(5)Cu2+在阴极上得电子,铜元素的化合价可以降至+1价、0价,部分CuCl析出是Cu2+得到电子生成CuCl,结合电荷守恒配平书写电极反应.
解答 解:(1)铜在氯气中燃烧生成固体氯化铜,观察到棕黄色的烟,反应为:Cu+Cl2$\frac{\underline{\;点燃\;}}{\;}$CuCl2,
故答案为:试管内有棕色烟产生;Cu+Cl2$\frac{\underline{\;点燃\;}}{\;}$CuCl2;
(2)氯化铜、氯化铁中的金属离子易水解,直接用水溶液配制溶液会产生浑浊,所以加入过量的盐酸来溶解氯化铜、氯化铁,以抑制氯化铜、氯化铁水解;用于调节pH以除去溶液1杂质可加试剂具有与酸反应,且不引入Cu2+之外的离子,故用CuO或Cu2(OH)或Cu2(OH)2CO3,调节pH目的是使溶液中铁离子转化为Fe(OH)3沉淀,过滤除去,且不能引入新杂质,
故答案为:避免Cu2+水解;c;
(3)根据信息可知:在加热条件下,SO2与铜离子反应生成CuCl白色沉淀和SO42-,其反应的离子方程式为:2Cu2++2Cl-+SO2+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+4H++SO42-,
故答案为:2Cu2++2Cl-+SO2+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+4H++SO42-;
(4)氢氧化钠溶液吸收氯气,生成有次氯酸钠,生铁在次氯酸钠和氢氧化钠的混合溶液中发生电化学腐蚀,碳等杂质为正极,铁为负极.负极的电极反应式为Fe-2e-=Fe2+,Fe2++2OH-=Fe(OH)2,4Fe(OH)2+O2+2H2O=4Fe(OH)3,正极的电极反应式为ClO-+2e-+H2O=Cl-+2OH-,红褐色沉淀为氢氧化铁,
故答案为:Fe(OH)3;ClO-+2e-+H2O=Cl-+2OH-;
(5)以石墨为电极,电解CuCl2溶液时发现阴极上也会有部分CuCl析出,阴极上是得到电子发生还原反应,Cu2+得到电子生成CuCl,电极反应为:Cu2++e-+Cl-=CuCl,
故答案为:Cu2++e-+Cl-=CuCl.
点评 本题以实验室制备氯化铜为背景,考查了物质的制备实验操作、离子检验、除杂质、离子方程式的书写、原电池原理的应用等,题目涉及的知识点较多,侧重于基础知识的综合应用的考查,题目难度中等.

 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案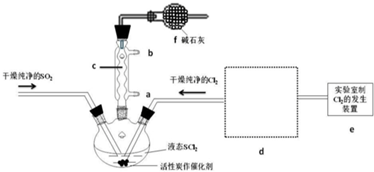
(1)仪器c的名称是球形冷凝管,装置f的作用是吸收逸出有毒的Cl2、SO2,防止空气中的水蒸气进入反应装置,防止SOCl2水解.
(2)SOCl2与水反应的化学方程式为SOCl2+H2O=SO2↑+2HCl↑.蒸干AlCl3溶液不能得到无水AlCl3,使SOCl2与AlCl3•6H2O混合加热,可得到无水AlCl3,试解释原因:AlCl3溶液易水解,AlCl3•6H2O与SOCl2混合加热,SOCl2与AlCl3•6H2O中的结晶水作用,生成无水AlCl3及SO2和HCl气体,SOCl2吸水,产物SO2和HCl抑制AlCl3水解.
(3)下列四种制备SO2的方案中最佳选择是丁.
| 方案 | 甲 | 乙 | 丙 | 丁 |
| 发生装置 |  |  |  | 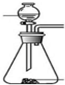 |
| 所选试剂 | NaHSO3固体 | 18.4mol/LH2SO4+Cu | 4mol/LHNO3+Na2SO3 | 70%H2SO4+K2SO3 |
(5)试验结束后,将三颈烧瓶中混合物分离开的实验操作是蒸馏;(已知SCl2的沸点为50℃)若反应中消耗的Cl2的体积为896ml(已转化为标准状况,SO2足量),最后得到纯净的SOCl24.76g,则SOCl2的产率为50% (保留三位有效数字).
已知生成氢氧化物的pH和有关硫化物的Ksp如表:
| 物质 | MnS | CuS | PbS |
| Ksp | 2.5×10-13 | 6.3×10-36 | 8.0×10-28 |
| 物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 8.3 |
| 完全沉淀pH | 3.7 | 9.6 | 9.8 |
2Fe3++SO2+2H2O═2Fe2++SO42-+4H+.
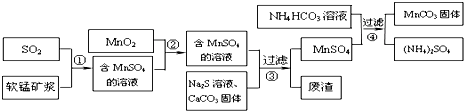
(1)流程①中所得MnSO4溶液的pH比软锰矿浆的pH小(填“大”或“小”),该流程可与工业制备硫酸(填写工业生产名称)联合,生产效益更高.
(2)反应②的目的是将溶液中的Fe2+氧化成Fe3+,其离子反应方程式为 MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,这样设计的目的和原理是使Fe2+转变为Fe3+,Fe3+完全沉淀的pH较低(或Fe3+更易沉淀).
(3)反应③中硫化钠的作用是使重金属离子转化为硫化物沉淀,碳酸钙的作用是与溶液中的酸反应,使溶液中的Fe3+、Al3+转化为氢氧化物沉淀.
(4)反应④发生的化学反应为:MnSO4+2NH4HCO3=MnCO3↓+(NH4)2SO4+CO2↑+H2O.反应中通常需加入稍过量的NH4HCO3,且控制溶液的pH为6.8~7.4.加入稍过量的NH4HCO3的目的是使MnCO3沉淀完全,溶液的pH不能过低的原因是MnCO3沉淀量少,NH4HCO3与酸反应(或MnCO3、NH4HCO3与酸反应溶解) .
(5)软锰矿中锰的浸出有两种工艺:
工艺A:软锰矿浆与含SO2的工业废气反应
工艺B:软锰矿与煤炭粉混合,焙烧后加稀硫酸溶解.
其中工艺A的优点是节约能源、治理含SO2的工业废气等.(答对1个即可)
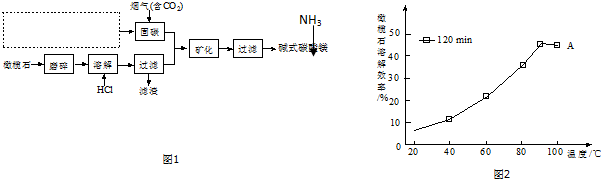
 .
.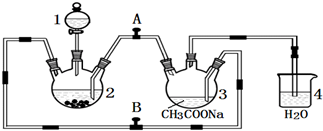
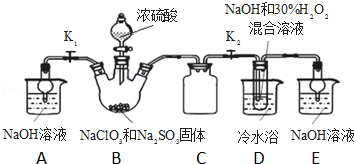
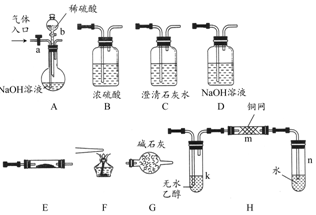 如图所示为常见气体制备、分离、干燥和性质验证的部分仪器装置(加热设备及夹持固定装置均略去),请根据要求完成下列各题(仪器装置可任意选用,必要时可重复选择).
如图所示为常见气体制备、分离、干燥和性质验证的部分仪器装置(加热设备及夹持固定装置均略去),请根据要求完成下列各题(仪器装置可任意选用,必要时可重复选择).