��Ŀ����
6��Ӧ��������Ⱦ�����ƿ���������Ҫ�Ӷ�����֣�I���о����֣�NOx����������Ҫ�ɷ�֮һ��NOx��Ҫ��Դ������β����
��֪��N2��g��+O2��g��?2NO��g����H=+180.50kJ•mol-1
2CO��g��+O2��g��?2CO2��g����H=-566.00kJ•mol-1
Ϊ�˼��������Ⱦ���������������β�������ܿڲ��ô�����NO��COת��������Ⱦ����������ѭ����д���÷�Ӧ���Ȼ�ѧ����ʽ2NO��g��+2CO��g��$\frac{\underline{\;����\;}}{\;}$2CO2��g��+N2��g����H=-746.50 kJ•mol-1��
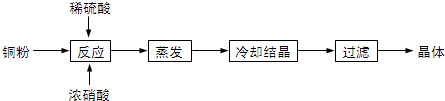
II���������������Դ�ɼ�����Ⱦ������������⣮�״���һ�ֿ������������Դ�����й����Ŀ�����Ӧ��ǰ����һ����������CO��H2�ϳ�CH3OH��CO��g��+2H2��g��?CH3OH��g������2L�ܱ������г������ʵ���֮��Ϊ1��2��CO��H2���ڴ��������³�ַ�Ӧ��ƽ��������CH3OH����������ڲ�ͬѹǿ�����¶ȵı仯��ͼ1��ʾ��
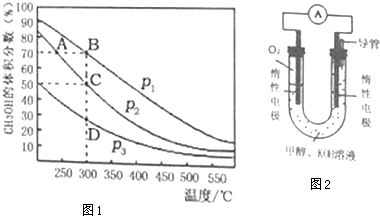
��1���÷�Ӧ�ķ�Ӧ�ȡ�H��0���������������ѹǿ����Դ�С��P1��P2���������������
��2���÷�Ӧ��ѧƽ�ⳣ������ʽΪK=$\frac{c��CH{\;}_{3}OH��}{c��CO��c��H{\;}_{2}��{\;}^{2}}$��
��3�����и����У�����˵���÷�Ӧ�Ѿ��ﵽƽ�����BC��
A������������ѹǿ���ٱ仯
B��v��CO����v��H2����v��CH3OH��=1��2��1
C�������ڵ��ܶȲ��ٱ仯
D�������ڻ�������ƽ����Է����������ٱ仯
E�������ڸ���ֵ������������ٱ仯
��4��ij�¶��£��ڱ�֤H2Ũ�Ȳ��������£����������������ƽ��C������ĸ����
A��������Ӧ�����ƶ� B�����淴Ӧ�����ƶ� C�����ƶ�
�������жϵ��������ڱ�֤H2Ũ�Ȳ��������£����������������˵��c��CH3OH����c��CO��ͬ�ȱ�����С����Ũ����Qc=$\frac{c��CH{\;}_{3}OH��}{c��CO��c��H{\;}_{2}��{\;}^{2}}$=K������ƽ�ⲻ�ƶ���
III������ȼ�շ�Ӧԭ�����ϳɵļ״����������ͼ2��ʾ��ȼ�ϵ��װ�ã�
��1�������缫��ӦʽΪCH3OH-6e-+8OH-=CO32-+6H2O��
��2����ع���ʱ��������ǿ��ΪI��1��������������Ϊq��NAΪ����٤��������ֵ�����װ��ÿ�������ļ״������ʵ���Ϊ$\frac{10I}{qN{\;}_{A}}$mol�����軯ѧ��ȫ��ת��Ϊ���ܣ���
���� I����֪��N2��g��+O2��g��?2NO��g����H=+180.50kJ•mol-1��
2CO��g��+O2��g��?2CO2��g����H=-566.00kJ•mol-1��
���ݸ�˹���ɣ���-�ټ��㣻
II����1����ͼ��֪�������¶ȣ�ƽ�������ƶ���˵���÷�Ӧ�ġ�H��0��ͬ�¶��£�����ѹǿ��ƽ�������ƶ���CH3OH�������������
��2������ƽ�ⳣ���ı���ʽΪ������Ũ�ȵ��ݴη�֮�����Ϸ�Ӧ��Ũ�ȵ��ݴη�֮����
��3�����淴Ӧ����ƽ��ʱ��ͬ�����ʵ�����������ȣ�����ֵ�Ũ�ȡ��������ֲ��䣬�ɴ�����������һЩ�����䣬�ж�ƽ���������Ӧ�淴Ӧ���з����仯�����������ɱ仯�����仯˵������ƽ�⣻
��4��ij�¶��£��ڱ�֤H2Ũ�Ȳ��������£����������������˵��c��CH3OH����c��CO��ͬ�ȱ�����С���Ũ����Qc��K�Ĺ�ϵ�жϣ�
III����1������Ϊ�״�ʧ���ӷ���������Ӧ�Ĺ��̣�ע��������ҺΪ���ԣ��ݴ���д�缫��Ӧʽ��
��2������Q=It��N=$\frac{Q}{e}$���CH3OH-6e-+8OH-=CO32-+6H2O���㣮
��� �⣺I����֪��N2��g��+O2��g��?2NO��g����H=+180.50kJ•mol-1��
2CO��g��+O2��g��?2CO2��g����H=-566.00kJ•mol-1��
���ݸ�˹���ɣ���-�ٵõ���2NO��g��+2CO��g��$\frac{\underline{\;����\;}}{\;}$2CO2��g��+N2��g����H=-746.50 kJ•mol-1��
�ʴ�Ϊ��2NO��g��+2CO��g��$\frac{\underline{\;����\;}}{\;}$2CO2��g��+N2��g����H=-746.50 kJ•mol-1��
II����1����ͼ��֪�������¶ȣ�CH3OH�����������С��ƽ�������ƶ�����÷�Ӧ�ġ�H��0��300��ʱ������ѹǿ��ƽ�������ƶ���CH3OH�����������������p1��p2���ʴ�Ϊ����������
��2����Ϊƽ�ⳣ���ı���ʽΪ������Ũ�ȵ��ݴη�֮�����Ϸ�Ӧ��Ũ�ȵ��ݴη�֮�������Ը÷�Ӧ��ѧƽ�ⳣ������ʽΪ K=$\frac{c��CH{\;}_{3}OH��}{c��CO��c��H{\;}_{2}��{\;}^{2}}$���ʴ�Ϊ��K=$\frac{c��CH{\;}_{3}OH��}{c��CO��c��H{\;}_{2}��{\;}^{2}}$��
��3��A���淴Ӧ���л���������ʵ�����С�����º�����ѹǿ��С��������ѹǿ���ֲ���˵������ƽ�⣬��A��ѡ��
B��v��CO����v��H2����v��CH3OH��=1��2��1��δ˵�����淴Ӧ������˵����Ӧ����ƽ�⣬��Bѡ��
C������������������䣬���º����£������������ܶ�ʼ�ձ��ֲ��䣬����˵����Ӧ����ƽ�⣬��Cѡ��
D������������������䣬�淴Ӧ���л���������ʵ�����С��ƽ����Է�����������ƽ����Է�����������˵������ƽ�⣬��D��ѡ��
E�������ڸ���ֵ������������ٱ仯˵������ƽ�⣬��E��ѡ��
��ѡ��BC��
��4��ij�¶��£��ڱ�֤H2Ũ�Ȳ��������£����������������˵��c��CH3OH����c��CO��ͬ�ȱ�����С����Ũ����Qc=$\frac{c��CH{\;}_{3}OH��}{c��CO��c��H{\;}_{2}��{\;}^{2}}$=K������ƽ�ⲻ�ƶ���
�ʴ�Ϊ��C���ڱ�֤H2Ũ�Ȳ��������£����������������˵��c��CH3OH����c��CO��ͬ�ȱ�����С����Ũ����Qc=$\frac{c��CH{\;}_{3}OH��}{c��CO��c��H{\;}_{2}��{\;}^{2}}$=K������ƽ�ⲻ�ƶ���
��1���״�ȼ�ϼ��Ե�أ����Ը�����ӦΪ�״�ʧ���ӽ������������̼������ӣ��缫��ӦʽΪ��CH3OH-6e-+8OH-=CO32-+6H2O���ʴ�Ϊ��CH3OH-6e-+8OH-=CO32-+6H2O��
��2������Q=It=I��60s=60I��N=$\frac{Q}{e}$=$\frac{60I}{q}$����
��CH3OH��6e-
1mol 6NA��
n $\frac{60I}{q}$��
n=$\frac{10I}{qN{\;}_{A}}$��
�ʴ�Ϊ��$\frac{10I}{qN{\;}_{A}}$��
���� ���⿼���˹���ɵ�Ӧ�á���ѧƽ��Ӱ�����ء�ƽ��״̬�жϡ���ѧƽ��ͼ���Լ�ȼ�ϵ�ص�ԭ���ȣ�����֪ʶ��϶ࡢ�ۺ��Խ�ǿ����ֿ�����ѧ���ķ������������������Ӧ��������

| A�� | HF���룺HF��aq��?H+��aq��+F-��aq����H=+10.4kJ/mol | |
| B�� | ˮ������0.1mol F-ʱ�����յ�����Ϊ6.77kJ | |
| C�� | �к��Ⱦ�Ϊ57.3 kJ/mol | |
| D�� | ��0.1mol HF��0.1mol NaOH ��������Һ��Ϻ�ų�������Ϊ6.77kJ |
| A�� | ��������ø��������ˮ������ղ���Ϊ������ | |
| B�� | ������Һ���루NH4��2SO4Ũ��Һ����ʹ����� | |
| C�� | ��Ȼ�����ʽ���̼���⡢����������Ԫ����� | |
| D�� | ������͵����ʶ���ֻ�ܺͼӦ���������� |