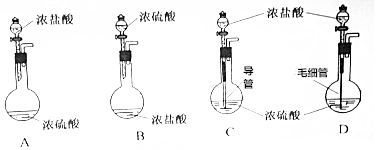
题目内容
2.碳酸锰(MnCO3)是理想的高性能强磁性材料,也是制备Mn2O3、MnO2等锰的氧化物的重要原料,广泛用于电子、化工、医药等行业.一种制备MnCO3的生产流程如图所示.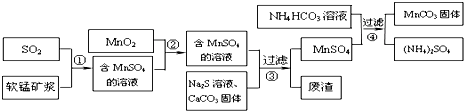
已知生成氢氧化物的pH和有关硫化物的Ksp如表:
| 物质 | MnS | CuS | PbS |
| Ksp | 2.5×10-13 | 6.3×10-36 | 8.0×10-28 |
| 物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 8.3 |
| 完全沉淀pH | 3.7 | 9.6 | 9.8 |
2Fe3++SO2+2H2O═2Fe2++SO42-+4H+.
(1)流程①中所得MnSO4溶液的pH比软锰矿浆的pH小(填“大”或“小”),该流程可与工业制备硫酸(填写工业生产名称)联合,生产效益更高.
(2)反应②的目的是将溶液中的Fe2+氧化成Fe3+,其离子反应方程式为 MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,这样设计的目的和原理是使Fe2+转变为Fe3+,Fe3+完全沉淀的pH较低(或Fe3+更易沉淀).
(3)反应③中硫化钠的作用是使重金属离子转化为硫化物沉淀,碳酸钙的作用是与溶液中的酸反应,使溶液中的Fe3+、Al3+转化为氢氧化物沉淀.
(4)反应④发生的化学反应为:MnSO4+2NH4HCO3=MnCO3↓+(NH4)2SO4+CO2↑+H2O.反应中通常需加入稍过量的NH4HCO3,且控制溶液的pH为6.8~7.4.加入稍过量的NH4HCO3的目的是使MnCO3沉淀完全,溶液的pH不能过低的原因是MnCO3沉淀量少,NH4HCO3与酸反应(或MnCO3、NH4HCO3与酸反应溶解) .
(5)软锰矿中锰的浸出有两种工艺:
工艺A:软锰矿浆与含SO2的工业废气反应
工艺B:软锰矿与煤炭粉混合,焙烧后加稀硫酸溶解.
其中工艺A的优点是节约能源、治理含SO2的工业废气等.(答对1个即可)
分析 软锰矿主要成分为MnO2,其中含有铁、铝、硅的氧化物和少量重金属化合物杂质,用软锰矿与来自工业废气主要是SO2反应生成硫酸锰,另外还原硫酸铁、硫酸亚铁等,再加入二氧化锰反应使亚铁离子被氧化成铁离子,得到含有硫酸锰的溶液中再加入硫化钠和碳酸钙固体,反应后过滤得硫酸锰溶液,在硫酸锰溶液中加入碳酸氢钠得碳酸锰沉淀和硫酸铵溶液,过滤得碳酸锰固体,
(1)软锰矿浆是二氧化锰,MnSO4溶液水解显酸性,Fe3+将SO2氧化为硫酸;
(2)MnO2可将Fe2+氧化成Fe3+,Fe3+完全沉淀的pH较Fe2+低;
(3)碳酸钙与溶液中的H+反应,使溶液中的PH升高;
(4)加入一种反应物能提高另一种反应物的装化率;MnCO3,NH4HCO3与酸反应;
(5)锰矿与煤炭粉混合,焙烧生成二氧化硫,污染空气.
解答 解:(1)软锰矿浆是二氧化锰,MnSO4溶液水解先酸性,根据2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.Fe3+可将SO2氧化为硫酸,故答案为:小;工业制备硫酸;
(2)MnO2可将Fe2+氧化成Fe3+,反应的离子方程式为MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,Fe3+完全沉淀的pH较Fe2+低,所以将溶液中的Fe2+氧化成Fe3+,
故答案为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;使Fe2+ 转变为Fe3+,Fe3+完全沉淀的pH较低(或Fe3+更易沉淀);
(3)碳酸钙与溶液中的H+反应,使溶液中的PH升高,使溶液中的Fe3+、Al3+转化为氢氧化物沉淀,
故答案为:与溶液中的酸反应,使溶液中的Fe3+、Al3+转化为氢氧化物沉淀;
(4)加入稍过量的NH4HCO3能提高MnSO4的装化率,使MnCO3沉淀完全,溶液的pH不过低,H+可与MnCO3,NH4HCO3反应,
故答案为:使MnCO3沉淀完全;MnCO3沉淀量少,NH4HCO3与酸反应(或MnCO3、NH4HCO3与酸反应溶解);
(5)锰矿与煤炭粉混合,焙烧生成二氧化硫,污染空气,而工艺A不仅不产生二氧化硫,且能生产硫酸,故答案为:节约能源、治理含SO2的工业废气等.
点评 本题考查了流程分析,反应过程理解应用,反应现象和产物的判断,注意基本实验的操作步骤,离子方程式书写等,题目难度中等.

 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案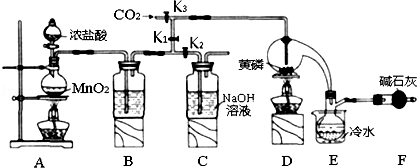
已知:①黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5;
②PCl3遇水会强烈水解生成 H3PO3和HC1;
③PCl3遇O2会生成P0Cl3,P0Cl3溶于PCl3;
④PCl3、POCl3的熔沸点见下表:
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
(1)A装置中制氯气的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)装置F的名称是干燥管,其中装的碱石灰的作用是吸收多余的氯气、防止空气中的H2O进入烧瓶和PCl3 反应;
(3)实验时,检査装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷.通干燥CO2的作用是排尽装置中的空气,防止白磷自燃;
(4)粗产品中常含有POCl3、PCl5等.加入黄磷加热除去PCl5后,通过蒸馏(填实验操作名称),即可得到较纯净的PCl3;
(5)实验结束时,可以利用C中的试剂吸收多余的氯气,C中反应的离子方程式为Cl2+2OH-=Cl-+ClO-+2H2O;
(6)通过下面方法可测定产品中PCl3的质量分数
①迅速称取1.00g产品,加水反应后配成250mL溶液;
②取以上溶液25.00mL,向其中加入10.00mL 0.1000mol•L-1碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000mol•L-1的Na2S2O3,溶液滴定;
③重复②、③操作,平均消耗Na2S2O3溶液8.40ml.
已知:H3PO3+H2O+I2═H3PO4+2HI,I2+2Na2S2O3═2NaI+Na2S4O6,假设测定过程中没有其他反应,根据上述数据,该产品中PC13的质量分数为79.75%.
| A. | Y的能量一定高于N | |
| B. | X、Y的能量总和高于M、N的能量总和 | |
| C. | 因为该反应为放热反应,故不必加热就可发生 | |
| D. | 断裂X、Y的化学键所吸收的能量高于形成M、N的化学键所放出的能量 |
| A. | HF电离:HF(aq)?H+(aq)+F-(aq)△H=+10.4kJ/mol | |
| B. | 水解消耗0.1mol F-时,吸收的热量为6.77kJ | |
| C. | 中和热均为57.3 kJ/mol | |
| D. | 含0.1mol HF、0.1mol NaOH 的两种溶液混合后放出的热量为6.77kJ |
| A. | 蛋白质在酶的作用下水解的最终产物为氨基酸 | |
| B. | 向蛋白质溶液加入(NH4)2SO4浓溶液,会使其变性 | |
| C. | 天然蛋白质仅由碳、氢、氧、氮四种元素组成 | |
| D. | 氨基酸和蛋白质都是只能和碱反应的酸性物质 |