题目内容
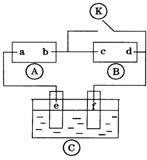 如图
如图 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现 上的c点显红色.为实现铁上镀铜,接通
上的c点显红色.为实现铁上镀铜,接通 后,使c、d两点短路.下列叙述正确的是( )
后,使c、d两点短路.下列叙述正确的是( )| A、a为直流电源的负极 |
| B、d极发生的反应为2H++2e-=H2↑ |
| C、f电极为铜板 |
| D、e极发生的反应为Cu-2e-=Cu2+ |
考点:电解原理
专题:电化学专题
分析:A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后发现B上的c点显红色,
则c极为电解池阴极,d为阳极,c电极上氢离子放电生成氢气,d电极上氯离子放电生成氯气,则a是直流电源正极,b是直流电源负极;
为实现铁上镀铜,接通K后,使c、d两点短路,e是电解池阳极,f是阴极,电镀时,镀层作阳极,镀件作阴极,以此解答该题.
则c极为电解池阴极,d为阳极,c电极上氢离子放电生成氢气,d电极上氯离子放电生成氯气,则a是直流电源正极,b是直流电源负极;
为实现铁上镀铜,接通K后,使c、d两点短路,e是电解池阳极,f是阴极,电镀时,镀层作阳极,镀件作阴极,以此解答该题.
解答:
解:A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后发现B上的c点显红色,
则c极为电解池阴极,d为阳极,c电极上氢离子放电生成氢气,d电极上氯离子放电生成氯气,则a是直流电源正极,b是直流电源负极;
为实现铁上镀铜,接通K后,使c、d两点短路,e是电解池阳极,f是阴极,电镀时,镀层作阳极,镀件作阴极,
A.通过以上分析知,a是直流电源正极,故A错误;
B.接通K前,c极为电解池阴极,d为阳极,为氯离子放电生成氯气,故B错误;
C.为实现铁上镀铜,铜作阳极,铁作阴极,所以e电极为铜板,故C错误;
D.e电极是阳极,阳极上失电子发生氧化反应,反应为Cu-2e-=Cu2+,故D正确.
故选D.
则c极为电解池阴极,d为阳极,c电极上氢离子放电生成氢气,d电极上氯离子放电生成氯气,则a是直流电源正极,b是直流电源负极;
为实现铁上镀铜,接通K后,使c、d两点短路,e是电解池阳极,f是阴极,电镀时,镀层作阳极,镀件作阴极,
A.通过以上分析知,a是直流电源正极,故A错误;
B.接通K前,c极为电解池阴极,d为阳极,为氯离子放电生成氯气,故B错误;
C.为实现铁上镀铜,铜作阳极,铁作阴极,所以e电极为铜板,故C错误;
D.e电极是阳极,阳极上失电子发生氧化反应,反应为Cu-2e-=Cu2+,故D正确.
故选D.
点评:本题综合考查原电池和电解池知识,侧重于学生的分析能力和电化学知识的综合应用的考查,为高考常见题型和高频考点,难度中等,注意把握电极方程式的书写和判断.

练习册系列答案
相关题目
下列有关SO2与SiO2的比较,正确的是( )
| A、它们均为酸性氧化物 |
| B、都溶于水,都能与强碱反应 |
| C、S元素和Si元素化合价都为+4价,因此从氧化还原角度考虑他们具有一样的性质 |
| D、SiO2可与HF反应,这是SiO2作为酸性氧化物的通性 |
下列离子组能大量共存的是( )
| A、使甲基橙呈红色的溶液中K+、Na+、NO3-、S2O32- |
| B、NH4+、Fe3+、CO32-、CH3COO- |
| C、使酚酞变红色的溶液中:Na+、Cl-、K+、AlO2- |
| D、无色透明溶液中:SO32-、Cl-、K+、Cr2O72- |
将NaCl固体溶解在水中,下列相关描述不正确的是( )
| A、NaCl═Na++Cl- |
| B、NaCl溶液中存在自由移动的水合钠离子、水合氯离子 |
| C、该过程中,水分子的作用是氯化钠溶液能够导电的重要原因 |
| D、氯化钠固体中不存在钠离子、氯离子,所以氯化钠固体不导电 |
下列有关叙述正确的是( )
| A、溶液因不带电而稳定,胶体因带电而不稳定 |
| B、做焰色反应实验前,铂丝应先用盐酸洗涤后灼烧至无色 |
| C、氯水与亚硫酸钠溶液的混合液,漂白性更强 |
| D、不慎将浓硫酸沾到皮肤上,立即用大量水冲洗,然后涂上烧碱溶液 |
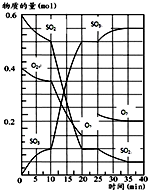 500℃时,将SO2和O2置于一容积固定为2L的密闭容器中发生反应,反应过程中SO2、O2和SO3物质的量变化如图所示.
500℃时,将SO2和O2置于一容积固定为2L的密闭容器中发生反应,反应过程中SO2、O2和SO3物质的量变化如图所示.

 的质量分数,在实验室中按以下步骤进行实验:
的质量分数,在实验室中按以下步骤进行实验: