题目内容
为测定某有机化合物A的结构,进行如下实验:
(一)分子式的确定:
(1)将有机物A置于氧气流中充分燃烧,实验测得:生成5.4g H2O和8.8g CO2,消耗氧气6.72L(标准状况下),则该物质中各元素的原子个数比是 .
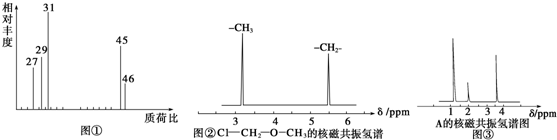
(2)用质谱仪测定该有机化合物的相对分子质量,得到如图①所示质谱图,则其相对分子质量为 ,该物质的分子式是 .
(3)根据价键理论,预测A的可能结构并写出结构简式 .
(二)结构式的确定:
(4)核磁共振氢谱能对有机物分子中不同化学环境的氢原子给出不同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目.例如:甲基氯甲基醚(ClCH2OCH3)有两种氢原子如图②.经测定,有机物A的核磁共振氢谱示意图如图③,则A的结构简式为 .
(一)分子式的确定:
(1)将有机物A置于氧气流中充分燃烧,实验测得:生成5.4g H2O和8.8g CO2,消耗氧气6.72L(标准状况下),则该物质中各元素的原子个数比是
(2)用质谱仪测定该有机化合物的相对分子质量,得到如图①所示质谱图,则其相对分子质量为
(3)根据价键理论,预测A的可能结构并写出结构简式
(二)结构式的确定:
(4)核磁共振氢谱能对有机物分子中不同化学环境的氢原子给出不同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目.例如:甲基氯甲基醚(ClCH2OCH3)有两种氢原子如图②.经测定,有机物A的核磁共振氢谱示意图如图③,则A的结构简式为

考点:测定有机物分子的元素组成,有机物实验式和分子式的确定
专题:计算题,有机化学基础
分析:(1)根据质量守恒定律计算出有机物分子中含有C、H元素的物质的量,再根据氧原子质量守恒计算出该有机物分子中含有的氧原子的物质的量,最后计算出该物质中各元素的原子个数比;
(2)根据图①所示质谱图判断有机物A的相对分子量,再根据(1)的计算结果判断有机物A的分子式;
(3)根据分子式及书写同分异构体的方法写出A可能的同分异构体的结构简式;
(4)核磁共振氢谱图中含有几个峰,表示该有机物中含有几个位置不同的氢原子,据此判断有机物A的结构.
(2)根据图①所示质谱图判断有机物A的相对分子量,再根据(1)的计算结果判断有机物A的分子式;
(3)根据分子式及书写同分异构体的方法写出A可能的同分异构体的结构简式;
(4)核磁共振氢谱图中含有几个峰,表示该有机物中含有几个位置不同的氢原子,据此判断有机物A的结构.
解答:
解:(1)有机物A充分燃烧生成水的物质的量为:n(H2O)=
=0.3 mol,则含有的氢原子的物质的量为:n(H)=0.6 mol,
8.8g二氧化碳的物质的量为:n(CO2)=
=0.2 mol,则n(C)=0.2 mol,据氧原子守恒有:n(O)=n(H2O)+2n(CO2)-2n(O2)=0.3 mol+2×0.2 mol-2×
=0.1 mol,则:N(C):N(H):N(O)=n(C):n(H):n(O)=2:6:1,
故答案为:2:6:1;
(2)据(1)可知,该有机物A的实验式为C2H6O,设该有机物的分子式为(C2H6O)m,由图①质谱图知,最大的质荷比为46,则其相对分子质量为46,则:46m=46,解得:m=1,故其分子式为C2H6O,
故答案为:46;C2H6O;
(3)A的分子式为C2H6O,A为饱和化合物,有机物A的结构为:CH3CH2OH或CH3OCH3,
故答案为:CH3CH2OH、CH3OCH3;
(4)根据图③A的核磁共振氢谱图可知:A有三种不同类型的H原子,而CH3OCH3只有一种类型的H原子,故A的结构简式为CH3CH2OH,
故答案为:CH3CH2OH.
| 5.4g |
| 18g/mol |
8.8g二氧化碳的物质的量为:n(CO2)=
| 8.8g |
| 44g/mol |
| 6.72L |
| 22.4L/mol |
故答案为:2:6:1;
(2)据(1)可知,该有机物A的实验式为C2H6O,设该有机物的分子式为(C2H6O)m,由图①质谱图知,最大的质荷比为46,则其相对分子质量为46,则:46m=46,解得:m=1,故其分子式为C2H6O,
故答案为:46;C2H6O;
(3)A的分子式为C2H6O,A为饱和化合物,有机物A的结构为:CH3CH2OH或CH3OCH3,
故答案为:CH3CH2OH、CH3OCH3;
(4)根据图③A的核磁共振氢谱图可知:A有三种不同类型的H原子,而CH3OCH3只有一种类型的H原子,故A的结构简式为CH3CH2OH,
故答案为:CH3CH2OH.
点评:本题考查了有机物的分子式、结构简式确定的计算,题目难度中等,注意掌握确定有机物分子式、结构简式的方法,明确质谱仪中的质荷比、核磁共振氢谱中峰的含义为解答本题的关键.

练习册系列答案
相关题目
电子表所用电源常为微型银锌原电池,其电极为A2O和Zn,电解质溶液为KOH溶液,其电极反应分别为:Zn-2e-+2OH-=Zn(OH)2,Ag2O+H2O+2e-=Ag+2OH-,下列叙述正确的是( )
| A、Zn为正极,Ag2O为负极 |
| B、放电时,电池负极附近溶液的pH变大 |
| C、放电时,溶液中阴离子向Zn极方向移动 |
| D、放电时,电流由Zn极经外电路流向Ag2O极 |
下列不可以证明b、c金属性强弱的是 ( )
| A、最高价氧化物对应水化物的溶解性:b<c |
| B、单质与水反应的剧烈程度:b<c |
| C、相同条件下,氯化物水溶液的pH值:b<c |
| D、可以从b的氯化物水溶液中置换出b. |
将一定量下列溶液混合后加热蒸干并灼烧,所得固体不可能为纯净物的是( )
| A、FeCl3与FeCl2 |
| B、KHCO3与KOH |
| C、NH4Cl与NaCl |
| D、AlCl3与Al2(SO4)3 |
 在某有机物A的分子其结构简式如图,请回答.
在某有机物A的分子其结构简式如图,请回答.