题目内容
17.H、D、T三种原子,它们之间的关系是互为同位素,在标准状况下,它们的单质的密度之比是1:2:3,1mol各单质中,它们的质子数之比是1:1:1,在标准状况下,1L各种单质中它们的电子数之比是1:1:1.分析 质子数相同、中子数不同的同一元素互称同位素;标况下,气体摩尔体积相同,根据ρ=$\frac{M}{{V}_{m}}$计算其密度之比;1mol这几种单质,其分子数相等,根据每个分子中所含质子数比较总质子数;1L这几种气体单质其物质的量相等,根据每个分子中电子数计算电子总数,
解答 解:质子数相同、中子数不同的同一元素互称同位素,这几种原子其质子数相同、中子数不同,所以互称同位素;标况下,气体摩尔体积相同,根据ρ=$\frac{M}{{V}_{m}}$知,其密度之比等于摩尔质量之比=2:4:6=1:2:3;
1mol这几种单质,根据N=nNA知其分子数相等,这几种单质的质子数都相等,所以其总的质子数之比为1:1:1;根据n=$\frac{V}{{V}_{m}}$知,1L这几种气体单质其物质的量相等,每个分子中电子数相等,所以其电子总数相等,则总电子数之比为1:1::1,
故答案为:互为同位素;1:2:3;1:1:1;1:1:1.
点评 本题考查物质的量有关计算,为高频考点,侧重考查学生分析计算能力,明确各个物理量之间的关系式是解本题关键,注意密度与摩尔质量的关系,题目难度不大.

练习册系列答案
相关题目
7.下列说法中错误的是( )
①化学性质相似的有机物是同系物;
②分子组成相差一个或若干个CH2原子团的有机物是同系物;
③若烃中碳、氢元素的质量分数相同,它们必定是同系物;
④互为同分异构体的两种有机物的物理性质有差别,但化学性质必定相似;
⑤相对分子质量相同而结构不同的有机物互为同分异构体;
⑥石墨与金刚石分子式相同,结构不同,互为同分异构体.
①化学性质相似的有机物是同系物;
②分子组成相差一个或若干个CH2原子团的有机物是同系物;
③若烃中碳、氢元素的质量分数相同,它们必定是同系物;
④互为同分异构体的两种有机物的物理性质有差别,但化学性质必定相似;
⑤相对分子质量相同而结构不同的有机物互为同分异构体;
⑥石墨与金刚石分子式相同,结构不同,互为同分异构体.
| A. | ①②③④⑤⑥ | B. | 只有②③⑤ | C. | 只有①③④⑥ | D. | 只有①②③⑤ |
8.下列叙述中错误的是( )
| A. | 共价化合物中只有共价键,一定没有离子键 | |
| B. | 金属和非金属一定形成离子化合物 | |
| C. | 含有离子键的化合物一定是离子化合物 | |
| D. | 离子化合物中可能含有极性共价键 |
6.既能与酸又能与碱反应是两性化合物的特征.下列物质属于两性化合物的是( )
| A. | A1 | B. | Na2CO3 | C. | A1(OH)3 | D. | (NH4)2SO4 |
7.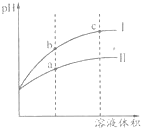 某温度下pH=2的盐酸和醋酸溶液分别加水稀释,pH值随溶液体积变化的曲线如图所示.下列说法正确的是( )
某温度下pH=2的盐酸和醋酸溶液分别加水稀释,pH值随溶液体积变化的曲线如图所示.下列说法正确的是( )
 某温度下pH=2的盐酸和醋酸溶液分别加水稀释,pH值随溶液体积变化的曲线如图所示.下列说法正确的是( )
某温度下pH=2的盐酸和醋酸溶液分别加水稀释,pH值随溶液体积变化的曲线如图所示.下列说法正确的是( )| A. | Ⅱ为盐酸稀释时pH变化曲线 | |
| B. | b点溶液的导电性比c点溶液的导电性强 | |
| C. | a点Kw数值比c点Kw数值大 | |
| D. | pH=2的盐酸和醋酸,盐酸的物质的量浓度大 |
 ;
; CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.