题目内容
8.下列叙述中错误的是( )| A. | 共价化合物中只有共价键,一定没有离子键 | |
| B. | 金属和非金属一定形成离子化合物 | |
| C. | 含有离子键的化合物一定是离子化合物 | |
| D. | 离子化合物中可能含有极性共价键 |
分析 A.共价化合物中只有共价键;
B.金属与非金属元素可能形成共价键;
C.含有离子键的化合物是离子化合物;
D.离子化合物中一定有离子键,可能含有共价键.
解答 解:A.共价化合物中只有共价键,一定没有离子键,含有离子键的是离子化合物,故A正确;
B.金属与非金属元素可能形成共价键,如铝与氯气反应生成的氯化铝为共价化合物,只含有共价键,故B错误;
C.含有离子键的化合物是离子化合物,如NaCl中钠离子与氯离子形成离子键,故C正确;
D.离子化合物中一定有离子键,可能含有共价键,如NaOH中含有O-H共价键,故D正确.
故选B.
点评 本题主要考查了键的极性与分子极性、化学键与化合物的关系,难度不大,注意举例说明,侧重于基础知识的考查.

练习册系列答案
相关题目
19.下列叙述能说明氯元素原子得电子能力比硫元素强的是( )
①HCl的溶解度比H2S大 ②HCl的酸性比H2S强
③HCl的稳定性比H2S强 ④还原性:Cl-<S2-
⑤HClO4的酸性比H2SO4强 ⑥单质熔点:S>Cl2
⑦Cl2能与H2S反应生成S ⑧在周期表中Cl处于S同周期的右侧
⑨Cl2与铁反应生成FeCl3,而S与铁反应生成FeS.
①HCl的溶解度比H2S大 ②HCl的酸性比H2S强
③HCl的稳定性比H2S强 ④还原性:Cl-<S2-
⑤HClO4的酸性比H2SO4强 ⑥单质熔点:S>Cl2
⑦Cl2能与H2S反应生成S ⑧在周期表中Cl处于S同周期的右侧
⑨Cl2与铁反应生成FeCl3,而S与铁反应生成FeS.
| A. | ③④⑤⑦⑧⑨ | B. | ③⑤⑥⑦⑧⑨ | C. | ②③④⑤⑦⑧ | D. | ①②④⑥⑧⑨ |
20.在HI溶液中滴加淀粉溶液无明显变化,但加入某种物质后,溶液立即变蓝.该物质可能是( )
| A. | FeCl3 | B. | K2SO3 | C. | NaOH | D. | Na2S |
18.向明矾溶液中逐滴加入Ba(OH)2溶液,当SO42-全部沉淀时,铝元素的主要存在形式为( )
| A. | AlO2- | B. | Al3+ | C. | Al(OH)3 | D. | Al(OH)3和Al3+ |
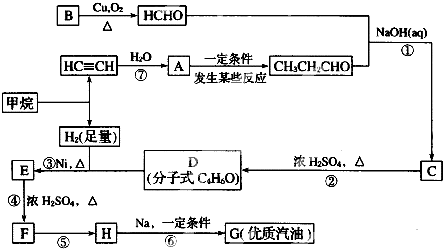
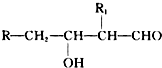
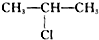
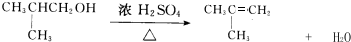 ;H→G
;H→G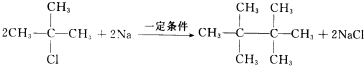 .
.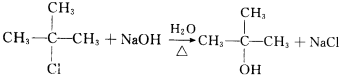 .
.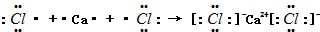 ;
;