题目内容
2.写出下列反应式:(1)苯制取硝基苯:
 ;
;(1)乙醇与乙酸反应:CH3COOH+CH3CH2OH
 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.
分析 (1)苯与浓硝酸、浓硫酸发生取代反应生成硝基苯;
(2)酯化反应的本质为酸脱羟基,醇脱氢,乙醇与乙酸反应反应生成乙酸乙酯和水.
解答 解:(1)苯易发生取代反应,与浓硝酸、浓硫酸的混合酸共热时发生硝化反应,即
故答案为:
(2)乙醇与乙酸在浓硫酸催化作用下发生酯化反应,生成乙酸乙酯和水,反应的化学方程式为:CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O,
CH3COOCH2CH3+H2O,
故答案为:CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.
点评 本题考查化学反应方程式的书写,侧重有机物性质的考查,为基础性习题,把握苯、乙酸、乙醇发生的取代反应为解答的关键,题目难度不大.

练习册系列答案
相关题目
12.下列有关离子浓度大小比较正确的是( )
| A. | 物质的量浓度均为0.1 mol•L-1的下列四种物质的溶液:①NaAlO2,②CH3COONa,③NaHCO3,pH由大到小的顺序是①③② | |
| B. | 等pH的①(NH4)2SO4,②NH4HSO4、③NH4Cl,NH4+浓度由大到小的顺序是①③② | |
| C. | 等浓度的①NH4Al(SO4)2、②(NH4)2CO3、③(NH4)2Fe(SO4)2,NH4+浓度由大到小的顺序是②③① | |
| D. | 相同温度下,将足量氯化银固体分别放入相同体积的①0.1 mol•L-1盐酸、②0.1 mol•L-1氯化镁溶液、③0.1 mol•L-1硝酸银溶液中,Ag+浓度由大到小的顺序是③②① |
10.今有A、B、C三种元素,A、C元素原子的最外层电子数分别为6、2,B元素原子最外层电子数是内层电子数的2倍,A原子比B原子多一个电子层,C原子比B原子少一个电子层,这三种元素分别是( )
| A. | S、Si、Be | B. | O、C、Mg | C. | O、Si、Ca | D. | S、C、He |
7.某溶液含有K+,Fe3+、SO42-、CO32-、I-中的一种或几种.取样,滴加KSCN溶液后显红色,为确定该溶液组成,还需检验的离子是( )
| A. | K+ | B. | I- | C. | SO42- | D. | CO32- |
14.下列有关元素周期律的叙述中,正确的是( )
| A. | 非金属性强弱:F2<Cl2 | B. | 金属性强弱:K<Na | ||
| C. | 酸性强弱:H2SO4<HClO4 | D. | 碱性强弱:NaOH<Mg(OH)2 |
11.现有8种元素的性质、数据如下表所列,它们属于第二或第三周期.
回答下列问题:
(1)③的元素符号是Li,⑧的元素名称是硼.
(2)在最高价氧化物的水化物中,酸性最强的化合物的名称是高氯酸.
碱性最强的化合物的电子式是: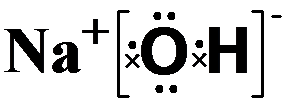 ,属离子化合物(填“离子”或“共价”).
,属离子化合物(填“离子”或“共价”).
(3)比较④和⑦的氢化物的稳定性(用分子式表示)NH3>PH3.
(4)写出⑦的最高价氧化物对应水化物跟它的氢化物反应的化学方程式:NH3+HNO3=NH4NO3.
(5)写出②最高价氧化物对应水化物跟⑤的氢化物水溶液反应的离子方程式:Mg(OH)2+2H+=Mg2++2H2O.
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
(1)③的元素符号是Li,⑧的元素名称是硼.
(2)在最高价氧化物的水化物中,酸性最强的化合物的名称是高氯酸.
碱性最强的化合物的电子式是:
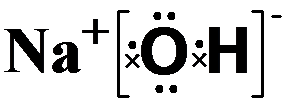 ,属离子化合物(填“离子”或“共价”).
,属离子化合物(填“离子”或“共价”).(3)比较④和⑦的氢化物的稳定性(用分子式表示)NH3>PH3.
(4)写出⑦的最高价氧化物对应水化物跟它的氢化物反应的化学方程式:NH3+HNO3=NH4NO3.
(5)写出②最高价氧化物对应水化物跟⑤的氢化物水溶液反应的离子方程式:Mg(OH)2+2H+=Mg2++2H2O.
12.下列溶液中微粒的物质的量浓度关系正确的是( )
| A. | 0.1mol/L NaHCO3溶液,c(Na+)>c(OH-)>c(HCO3-)>c(H+) | |
| B. | 0.1mol/L K2S溶液中,c(K+)=c(S2-)+c(HS-)+c(H2S) | |
| C. | 常温时pH=2的盐酸和pH=12的氨水中由水电离出的c(H+)相等 | |
| D. | pH=3的盐酸和pH=11的氨水等体积混合完全反应后c(Cl-)>c(NH4+)>c(OH-)>c(H+) |