题目内容
15.下列关于热化学反应的描述中正确的是( )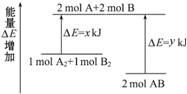
| A. | 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则H2SO4和Ba(OH)2反应的反应热△H=2×(-57.3)kJ•mol-1 | |
| B. | 燃料电池中将甲醇蒸气转化为氢气的热化学方程式是:CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H=-192.9 kJ•mol-1 则CH3OH(g)的燃烧热为192.9 kJ•mol-1 | |
| C. | 葡萄糖的燃烧热是2800 kJ•mol-1,则$\frac{1}{2}$C6H12O6(s)+3O2(g)═3CO2(g)+3H2O(l)△H=-1400 kJ•mol-1 | |
| D. | H2(g)的燃烧热是285.8 kJ•mol-1,则2H2O(g)═2H2(g)+O2(g)△H=+571.6 kJ•mol-1 |
分析 A.中和热是在稀溶液中,强酸与强碱反应生成1mol水的热效应,不包括生成沉淀的热效应;
B.燃烧热是在25℃,101Kp下,1mol可燃烧物完全燃烧生成稳定的氧化物的热效应;
C.反应热与反应物前的计量数成正比关系;
D.燃烧热是在25℃,101Kp下,1mol可燃烧物完全燃烧生成稳定的氧化物的热效应,一个反应正方向是放热,逆方向便是吸热.
解答 解:A.中和热是稀溶液强酸与强碱反应生成1mol水的热效应,不包括生成沉淀的热效应,H2SO4和Ba(OH)2反应会生成沉淀,所以反应热△H不能计算,故A错误;
B.燃烧热是在25℃,101Kp下,1mol可燃烧物完全燃烧生成稳定的氧化物的热效应,而方程式中的生成物是氢气,不是液态水,故CH3OH(g)的燃烧热不是192.9 kJ•mol-1,故B错误;
C.反应热与反应物前的计量数成正比关系,故C正确;
D.氢气的燃烧是放热反应,那么水的分解就是吸热反应,但燃烧热必须1mol可燃烧物完全燃烧生成稳定的氧化物的热效应,而选项中是气态水的分解,故D错误;
故选C.
点评 本题考查中和热、燃烧热的概念,注意1mol的使用和物质的状态,题目较简单.

练习册系列答案
相关题目
3.我国科学家通过测量SiO2中26Al和10Be两种元素的比例来确定“北京人”年龄,这种测量方法叫铝铍测年法.关于26Al和10Be的说法不正确的是( )
| A. | 10Be和9Be是中子数不同质子数相同的不同原子 | |
| B. | 10Be的原子核内中子数比质子数多 | |
| C. | 5.2g 26Al3+中所含的电子数约为6.02×1024 | |
| D. | 26Al和26Mg的质子数和核外电子数均不相同,中子数相同 |
20.Se是人体必需微量元素,下列关于${\;}_{34}^{78}Se$和${\;}_{34}^{80}Se$的说法不正确的是( )
| A. | ${\;}_{34}^{78}Se$和${\;}_{34}^{80}Se$互为同素异形体 | |
| B. | ${\;}_{34}^{78}Se$和${\;}_{34}^{80}Se$电子数相同 | |
| C. | ${\;}_{34}^{78}Se$和${\;}_{34}^{80}Se$分别含有44和46个中子 | |
| D. | ${\;}_{34}^{78}Se$和${\;}_{34}^{80}Se$互为同位素 |
7.反应2SO2(g)+O2(g)?2SO3(g)经一段时间后,SO3的浓度增加了0.3mol•L-1,已知此段时间内氧气的平均速率为0.015mol/(L•S)在这段时间内用( )
| A. | 2s | B. | 5 s | C. | 10 s | D. | 20 s |
4.在H2S和SO2的反应中,氧化产物与还原产物的物质的量比为( )
| A. | 3:2 | B. | 2:1 | C. | 1:1 | D. | 3:13 |
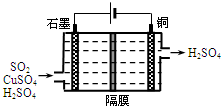 一种以铜作催化剂脱硫有如下两个过程:
一种以铜作催化剂脱硫有如下两个过程: