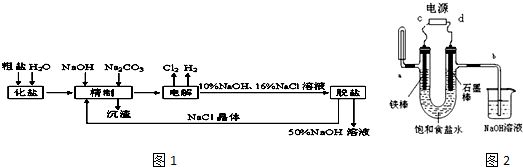
题目内容
6.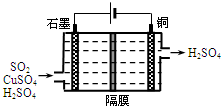 一种以铜作催化剂脱硫有如下两个过程:
一种以铜作催化剂脱硫有如下两个过程:①在铜的作用下完成工业尾气中SO2的部分催化氧化,所发生反应为:
2SO2+2nCu+(n+1)O2+(2-2n)H2O=2nCuSO4+(2-2n)H2SO4
从环境保护的角度看,催化脱硫的意义为减少酸雨的发生.
②利用如图所示电化学装置吸收另一部分SO2,并完成Cu的再生.写出装置内所发生反应的总的离子方程式:SO2+2H2O+Cu2+$\frac{\underline{\;电解\;}}{\;}$4H++SO42-+Cu.
分析 ①二氧化硫是一种有毒的气体,排放到空气中可引起酸雨的发生,对环境和人类健康有害,脱硫可以防止酸雨的发生;
②利用电解原理将二氧化硫转化成硫酸吸收,先写出两个电极上上发生的电极反应式,加和就可得到总的离子方程式.
解答 解:①二氧化硫是一种有毒的气体,能和水反应生成亚硫酸,亚硫酸被氧化成硫酸,脱硫可以减少二氧化硫的排放量,所以从环境保护的角度看,催化脱硫的意义为减少酸雨的发生;
故答案为:减少酸雨的发生;
②分析图中电解装置,可知左边石墨是电解池的阳极,右边是阴极;阳极放电的物质二氧化硫,失去电子生成硫酸根离子,电极反应式:SO2-2e-+2H2O=SO42-+2H+;阴极放电的物质时铜离子,得到电子被还原成单质铜,电极反应式:Cu2++2e-=Cu;将上述两电极的电极反应式得:SO2+2H2O+Cu2+$\frac{\underline{\;电解\;}}{\;}$4H++SO42-+Cu,
故答案为:SO2+2H2O+Cu2+$\frac{\underline{\;电解\;}}{\;}$4H++SO42-+Cu.
点评 本题考查了二氧化硫的污染和治理,电解原理,题目综合性强,题目难度不大,注意基础知识的掌握.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.下列有关实验误差分析中,不正确的是( )
| A. | 滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小 | |
| B. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏大 | |
| C. | 用湿润的pH试纸测溶液的pH,测定值一定有误差 | |
| D. | 测定中和反应的反应热时,将碱缓慢倒入酸中,所测中和热的值偏小 |
11.有关中和滴定有如下操作:①洗涤;②往滴定管内注入标准溶液;③滴定;④检查滴定管是否漏水;⑤用标准溶液润洗滴定管.其正确的操作顺序是( )
| A. | ⑤①②④③ | B. | ⑤①②④③ | C. | ⑤②①④③ | D. | ④①⑤②③ |
15.下列关于热化学反应的描述中正确的是( )

| A. | 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则H2SO4和Ba(OH)2反应的反应热△H=2×(-57.3)kJ•mol-1 | |
| B. | 燃料电池中将甲醇蒸气转化为氢气的热化学方程式是:CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H=-192.9 kJ•mol-1 则CH3OH(g)的燃烧热为192.9 kJ•mol-1 | |
| C. | 葡萄糖的燃烧热是2800 kJ•mol-1,则$\frac{1}{2}$C6H12O6(s)+3O2(g)═3CO2(g)+3H2O(l)△H=-1400 kJ•mol-1 | |
| D. | H2(g)的燃烧热是285.8 kJ•mol-1,则2H2O(g)═2H2(g)+O2(g)△H=+571.6 kJ•mol-1 |
16.下列有机物的系统命名正确的是( )
| A. | CH≡C-CH2CH3 丁炔 | B. | CH2═CH-CH=CH-CH3 1,3-二戊烯 | ||
| C. | 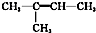 2-甲基丁烯 2-甲基丁烯 | D. | 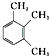 1,2,3-三甲苯 1,2,3-三甲苯 |
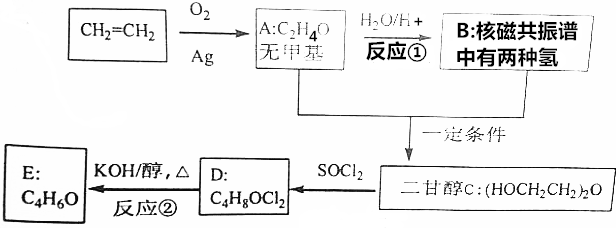
 DClCH2CH2OCH2CH2Cl;
DClCH2CH2OCH2CH2Cl;