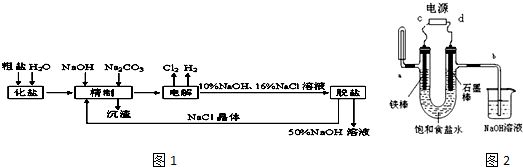
题目内容
7.反应2SO2(g)+O2(g)?2SO3(g)经一段时间后,SO3的浓度增加了0.3mol•L-1,已知此段时间内氧气的平均速率为0.015mol/(L•S)在这段时间内用( )| A. | 2s | B. | 5 s | C. | 10 s | D. | 20 s |
分析 根据速率之比等于化学计量数之比计算v(SO3),再利用△t=$\frac{△c}{△t}$计算.
解答 解:用O2表示的反应速率为0.015mol•L-1•s-1,
则v(SO3)=2v(O2)=2×0.015mol•L-1•s-1=0.03mol•L-1•s-1,
故反应时间=$\frac{0.3mol/L}{0.03mol/(L•s)}$=10s,
故选C.
点评 本题考查化学反应速率的有关计算,比较基础,注意对公式的理解与灵活运用,题目较简单.

练习册系列答案
相关题目
15.下列关于热化学反应的描述中正确的是( )
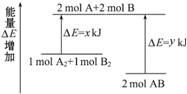

| A. | 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则H2SO4和Ba(OH)2反应的反应热△H=2×(-57.3)kJ•mol-1 | |
| B. | 燃料电池中将甲醇蒸气转化为氢气的热化学方程式是:CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H=-192.9 kJ•mol-1 则CH3OH(g)的燃烧热为192.9 kJ•mol-1 | |
| C. | 葡萄糖的燃烧热是2800 kJ•mol-1,则$\frac{1}{2}$C6H12O6(s)+3O2(g)═3CO2(g)+3H2O(l)△H=-1400 kJ•mol-1 | |
| D. | H2(g)的燃烧热是285.8 kJ•mol-1,则2H2O(g)═2H2(g)+O2(g)△H=+571.6 kJ•mol-1 |
2.下列物质中,含有共价键的离子化合物的是( )
| A. | MgCl2 | B. | HCl | C. | H2O | D. | NaOH |
12.下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
(1)④、⑤、⑥的原子半径由大到小的顺序为Na>Al>O.
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是HNO3>H2CO3>H2SiO3.
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中种
化合物的电子式: .
.
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用催
化剂为(填序号)ab. a.MnO2b.FeCl3 c.Na2SO3 d.KMnO4
(5)用电子式表示①、④两种元素形成18电子的形成过程 .
.
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是HNO3>H2CO3>H2SiO3.
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中种
化合物的电子式:
 .
.(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用催
化剂为(填序号)ab. a.MnO2b.FeCl3 c.Na2SO3 d.KMnO4
(5)用电子式表示①、④两种元素形成18电子的形成过程
 .
.
19.下列溶液不能区别SO2和CO2气体的( )
| A. | 稀盐酸 | B. | 品红溶液 | C. | 酸性高锰酸钾 | D. | 溴水 |
16.下列有机物的系统命名正确的是( )
| A. | CH≡C-CH2CH3 丁炔 | B. | CH2═CH-CH=CH-CH3 1,3-二戊烯 | ||
| C. | 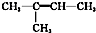 2-甲基丁烯 2-甲基丁烯 | D. | 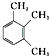 1,2,3-三甲苯 1,2,3-三甲苯 |
17.以下能说明氯的非金属性比硫强的事实是( )
| A. | 氯的最高价为+7价而硫的最高价为+6价 | |
| B. | HCl的酸性比H2S的酸性强 | |
| C. | H2S能被Cl2氧化成硫单质 | |
| D. | HClO的氧化性比H2SO4的氧化性强 |