题目内容
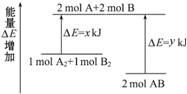
10.试回答下列各问题:(1)如图Ⅰ所示是1mol NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1.
(2)化学反应的能量变化与反应物和生成物的键能有关.

①已知:H2(g)+Cl2(g)═2HCl(g)△H=-185kJ/mol;
E(H-H)=436kJ/mol,E(Cl-Cl)=247kJ/mol,则E(H-Cl)=434KJ/mol.
②图Ⅱ表示氧族元素中的氧、硫、硒、碲生成氢化物时的△H数据,根据△H数据可确定a、b、c、d分别代表哪种元素,试写出硒化氢在标准状况下,发生分解反应的热化学方程式:H2Se(g)=Se(s)+H2(g)△H=-81kJ/mol.
(3)已知:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)
△H=-25kJ/mol ①
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)
△H=-47kJ/mol ②
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)
△H=+19kJ/mol ③
请写出CO还原FeO的热化学方程式:FeO(s)+CO(g)=Fe(s)+CO2(g)△H=-11KJ/mol.
分析 (1)由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量368-134=234kJ,根据热化学方程式书写原则进行书写;
(2)①反应热=反应物总键能-生成物总键能,据此计算;
②非金属元素氢化物的稳定性与生成1mol氢化物时的△H的关系为:根据元素周期律,同一主族元素非金属性越强,生成气态氢化物越容易,气态氢化物越稳定,而能量越低越稳定,所以a、b、c、d依次为:H2Te、H2Se、H2S、H2O,根据图象判断出abcd对应的各氢化物,根据焓变的大小书写热化学方程式;
(3)依据热化学方程式和盖斯定律计算得到所需热化学方程式.
解答 解:(1)由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量368-134=234kJ,反应热化学方程式为NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1,
故答案为:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1;
(2)①436kJ/mol+247kJ/mol-2E(H-Cl)=-185kJ/mol,解得E(H-Cl)=434KJ/mol,故答案为:434KJ/mol;
②a非金属元素氢化物的稳定性与生成1mol氢化物时的△H的关系为:根据元素周期律,同一主族元素非金属性越强,生成气态氢化物越容易,气态氢化物越稳定,而能量越低越稳定,所以a、b、c、d依次为:H2Te、H2Se、H2S、H2O,可知,b为硒化氢的生成热数据,则硒化氢分解吸热,△H=-81kJ/mol,所以H2Se发生分解反应的热化学反应方程式为:H2Se(g)=Se(s)+H2(g)△H=-81kJ/mol,
故答案为:H2Te、H2Se、H2S、H2O;H2Se(g)=Se(s)+H2(g)△H=-81kJ/mol;
(3)①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-25KJ/mol
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47KJ/mol
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+19KJ/mol
依据盖斯定律③×2+②-①×3得到:6FeO(s)+6CO(g)=6Fe(s)+6CO2(g)△H=-66 KJ/mol;
即热化学方程式为:FeO(s)+CO(g)=Fe(s)+CO2(g)△H=-11 KJ/mol;
故答案为:FeO(s)+CO(g)=Fe(s)+CO2(g)△H=-11 KJ/mol.
点评 本题考查了利用盖斯定律进行有关反应热的计算知识,题目难度中等,注意掌握盖斯定律的含义及应用盖斯定律书写热化学方程式的方法.

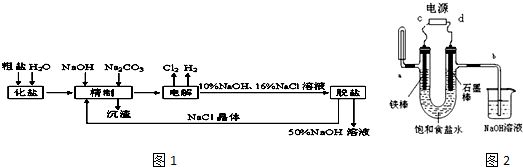
| A. | 第Ⅰ步反应后得到的滤液主要是含铝溶液 | |
| B. | 第Ⅱ步中盐酸表现出酸性、还原性,且必须过量 | |
| C. | 第Ⅲ步中Na2CO3主要作用是使Fe3+沉淀,滤渣主要为Fe(OH)3 | |
| D. | 第Ⅳ步操作为过滤,第Ⅴ步煅烧后,也可以在一氧化碳气体氛围中冷却 |
| A. | 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则H2SO4和Ba(OH)2反应的反应热△H=2×(-57.3)kJ•mol-1 | |
| B. | 燃料电池中将甲醇蒸气转化为氢气的热化学方程式是:CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H=-192.9 kJ•mol-1 则CH3OH(g)的燃烧热为192.9 kJ•mol-1 | |
| C. | 葡萄糖的燃烧热是2800 kJ•mol-1,则$\frac{1}{2}$C6H12O6(s)+3O2(g)═3CO2(g)+3H2O(l)△H=-1400 kJ•mol-1 | |
| D. | H2(g)的燃烧热是285.8 kJ•mol-1,则2H2O(g)═2H2(g)+O2(g)△H=+571.6 kJ•mol-1 |
| A. | MgCl2 | B. | HCl | C. | H2O | D. | NaOH |
| A. | 稀盐酸 | B. | 品红溶液 | C. | 酸性高锰酸钾 | D. | 溴水 |
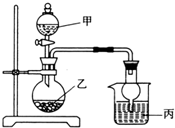 用如图所示装置进行实验(必要时可以进行加热),如表实验现象描述错误的是( )
用如图所示装置进行实验(必要时可以进行加热),如表实验现象描述错误的是( ) | 实验 | 试剂甲 | 试剂乙 | 试剂丙 | 丙中的现象 |
| A | H2O2 | MnO2 | FeCl2溶液 | 溶液由浅绿色变为棕黄色 |
| B | 浓氨水 | CaO | AgNO3溶液 | 有白色沉淀生成 |
| C | H2SO4 | Na2SO3 | BaCl2溶液 | 有白色沉淀生成 |
| D | 浓HNO3 | Cu | NaHCO3溶液 | 有无色气体生成 |
| A. | A | B. | B | C. | C | D. | D |