题目内容
 Ⅰ.短周期元素R被称为“生命元素”,R元素的最价高氧化物对应的水化物能与其气态氢化物化合生成盐A,写出生成A的化学方程式
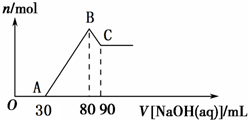
Ⅰ.短周期元素R被称为“生命元素”,R元素的最价高氧化物对应的水化物能与其气态氢化物化合生成盐A,写出生成A的化学方程式Ⅱ.将一定量Mg、Al合金溶于40mL的H2SO4溶液中,然后向所得溶液中滴加1mol?L-1的NaOH溶液,产生沉淀的物质的量(n)与滴加的NaOH溶液(mL)体积的关系如图所示.
(1)合金中Mg、Al的物质的量之比为
(2)所加硫酸的物质的量浓度为
考点:镁的化学性质,化学方程式的有关计算,铝的化学性质
专题:计算题
分析:Ⅰ.某短周期元素的气态氢化物与该元素最高价氧化物对应的水化物反应生成盐,该元素为氮元素,氮的最高价氧化物的水化物为硝酸,氮的氢化物为氨气,硝酸与氨气反应生成硝酸铵;
Ⅱ.由图象可知,从开始至加入NaOH溶液30mL,没有沉淀生成,说明硫酸有剩余,此段发生的反应为:H2SO4+2NaOH=Na2SO4+2H2O,当V(NaOH溶液)=80mL时,沉淀量最大,此时沉淀为Mg(OH)2和Al(OH)3,此段发生的反应为:Al3++3OH-=Al(OH)3↓,Mg2++2OH-=Mg(OH)2↓,80ml-90ml段沉淀的质量减少发生的反应为:Al(OH)3↓+OH-=[Al(OH)4]-,依据消耗的氢氧化钠的物质的量可求出氢氧化铝的物质的量,然后依据镁离子和铝离子沉淀消耗的氢氧化钠求出,氢氧化镁的物质的量,即可求出金属镁与铝的物质的量之比;
(2)有题意结合图象可知当加氢氧化钠体积为80ml时,溶质只有硫酸钠,依据钠原子和硫酸根离子个数守恒可计算出硫酸的物质的量,进而求出硫酸的浓度.
Ⅱ.由图象可知,从开始至加入NaOH溶液30mL,没有沉淀生成,说明硫酸有剩余,此段发生的反应为:H2SO4+2NaOH=Na2SO4+2H2O,当V(NaOH溶液)=80mL时,沉淀量最大,此时沉淀为Mg(OH)2和Al(OH)3,此段发生的反应为:Al3++3OH-=Al(OH)3↓,Mg2++2OH-=Mg(OH)2↓,80ml-90ml段沉淀的质量减少发生的反应为:Al(OH)3↓+OH-=[Al(OH)4]-,依据消耗的氢氧化钠的物质的量可求出氢氧化铝的物质的量,然后依据镁离子和铝离子沉淀消耗的氢氧化钠求出,氢氧化镁的物质的量,即可求出金属镁与铝的物质的量之比;
(2)有题意结合图象可知当加氢氧化钠体积为80ml时,溶质只有硫酸钠,依据钠原子和硫酸根离子个数守恒可计算出硫酸的物质的量,进而求出硫酸的浓度.
解答:
解:Ⅰ.某短周期元素的气态氢化物与该元素最高价氧化物对应的水化物反应生成盐,该元素为氮元素,氮的最高价氧化物的水化物为硝酸,氮的氢化物为氨气,硝酸与氨气反应生成硝酸铵,反应的方程式为:NH3+HNO3═NH4NO3,
故答案为:NH3+HNO3═NH4NO3;
Ⅱ.(1)Ⅱ.由图象可知,从开始至加入NaOH溶液30mL,没有沉淀生成,说明硫酸有剩余,此段发生的反应为:H2SO4+2NaOH=Na2SO4+2H2O,当V(NaOH溶液)=80mL时,沉淀量最大,此时沉淀为Mg(OH)2和Al(OH)3,此段发生的反应为:Al3++3OH-=Al(OH)3↓,Mg2++2OH-=Mg(OH)2↓,80ml-90ml段沉淀的质量减少发生的反应为:Al(OH)3↓+OH-=[Al(OH)4]-,
依据Al(OH)3↓+OH-=[Al(OH)4]-得:
1 1
n (Al(OH)3) 1mol?L-1×(90-80)×10-3L 解:n=0.01mol,依据原子个数守恒可知铝的物质的量为0.01mol;
则依据Al3++3OH-=Al(OH)3↓,可知沉淀铝离子消耗氢氧化钠0.03mol,
沉淀镁离子与铝离子共消耗氢氧化钠(80-30)×10-3L×1mol?L-1=0.05mol,则沉淀镁离子消耗的氢氧化钠为0.05mol-0.03mol=0.02mol,
依据:Mg2++2OH-=Mg(OH)2↓,
1 2
n(Mg2+) 0.02mol 得:n(Mg2+)=0.01mol,依据原子个数守恒可知镁的物质的量为0.01mol;
所以合金中Mg、Al的物质的量之比为:0.01mol:0.01mol=1:1;
故答案为:1:1;
(2)有题意结合图象可知当加氢氧化钠体积为80ml时,溶质只有硫酸钠,1mol硫酸钠电离产生2mol钠离子,消耗的氢氧化钠的物质的量为:0.08L×1mol?L-1=0.08mol,依据钠原子个数守恒可知生成的硫酸钠的物质的量为:
=0.04mol,依据硫酸根离子守恒,可知原硫酸中含有硫酸的物质的量为0.04mol,所以硫酸的物质的量浓度为:
=1mol/L,
故答案为:1mol/L.
故答案为:NH3+HNO3═NH4NO3;
Ⅱ.(1)Ⅱ.由图象可知,从开始至加入NaOH溶液30mL,没有沉淀生成,说明硫酸有剩余,此段发生的反应为:H2SO4+2NaOH=Na2SO4+2H2O,当V(NaOH溶液)=80mL时,沉淀量最大,此时沉淀为Mg(OH)2和Al(OH)3,此段发生的反应为:Al3++3OH-=Al(OH)3↓,Mg2++2OH-=Mg(OH)2↓,80ml-90ml段沉淀的质量减少发生的反应为:Al(OH)3↓+OH-=[Al(OH)4]-,
依据Al(OH)3↓+OH-=[Al(OH)4]-得:
1 1
n (Al(OH)3) 1mol?L-1×(90-80)×10-3L 解:n=0.01mol,依据原子个数守恒可知铝的物质的量为0.01mol;
则依据Al3++3OH-=Al(OH)3↓,可知沉淀铝离子消耗氢氧化钠0.03mol,
沉淀镁离子与铝离子共消耗氢氧化钠(80-30)×10-3L×1mol?L-1=0.05mol,则沉淀镁离子消耗的氢氧化钠为0.05mol-0.03mol=0.02mol,
依据:Mg2++2OH-=Mg(OH)2↓,
1 2
n(Mg2+) 0.02mol 得:n(Mg2+)=0.01mol,依据原子个数守恒可知镁的物质的量为0.01mol;
所以合金中Mg、Al的物质的量之比为:0.01mol:0.01mol=1:1;
故答案为:1:1;
(2)有题意结合图象可知当加氢氧化钠体积为80ml时,溶质只有硫酸钠,1mol硫酸钠电离产生2mol钠离子,消耗的氢氧化钠的物质的量为:0.08L×1mol?L-1=0.08mol,依据钠原子个数守恒可知生成的硫酸钠的物质的量为:
| 0.08mol |
| 2 |
| 0.04mol |
| 0.04L |
故答案为:1mol/L.
点评:本题考查了氮元素及其化合物的性质,镁、铝的性质及相关计算,题目难度中等,解答有关镁铝计算题时,分清各段发生的反应是解题的关键.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
在同温同压下,相同质量的下列气体中所含气体体积最大的是( )
| A、Cl2 |
| B、CO2 |
| C、CH4 |
| D、O2 |
下列离子方程式不正确的是( )
| A、向NH4Al(SO4)2溶液中滴入Ba(OH)2恰好使SO42-反应完全:NH4++2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+Al(OH)3↓+NH3?H2O |
| B、误将洁厕灵和“84”消毒液混合:2H++Cl-+ClO-═Cl2↑+H2O |
| C、向明矾溶液中加入少量的Ba(OH)2溶液:2Al3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓ |
| D、在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的离子方程式是:3NH4++Fe3++3SO42-+3Ba2++6OH-═3BaSO4↓+Fe(OH)3↓+3NH3?H2O |
 如图所示:
如图所示: (1)人类的生活和生产活动,可以说都离不开能源.在 ①石油、②电能、③风能、④煤、⑤天然气、⑥秸杆、⑦水力、⑧水煤气这些能源中,属于“二级能源”的是
(1)人类的生活和生产活动,可以说都离不开能源.在 ①石油、②电能、③风能、④煤、⑤天然气、⑥秸杆、⑦水力、⑧水煤气这些能源中,属于“二级能源”的是