题目内容
按要求完成下列氧化还原反应的分析.
(1)用双线桥表示反应4Fe(OH)2+O2+2H2O=4Fe(OH)3中电子转移的方向和数目,指明该反应的还原剂 .
(2)用单线桥表示反应Cu+4HNO3 (浓)=Cu(NO3)2+2NO2↑+2H2O中电子转移的方向和数目,该反应的氧化剂和还原剂的物质的量之比为 .
(3)已知反应Fe+CuSO4=FeSO4+Cu,试比较金属阳离子的氧化性:Cu2+ Fe2+(填“>”、“<”或“=”)
(1)用双线桥表示反应4Fe(OH)2+O2+2H2O=4Fe(OH)3中电子转移的方向和数目,指明该反应的还原剂
(2)用单线桥表示反应Cu+4HNO3 (浓)=Cu(NO3)2+2NO2↑+2H2O中电子转移的方向和数目,该反应的氧化剂和还原剂的物质的量之比为
(3)已知反应Fe+CuSO4=FeSO4+Cu,试比较金属阳离子的氧化性:Cu2+
考点:氧化还原反应的计算,氧化还原反应
专题:氧化还原反应专题
分析:(1)先找化合价变化的元素,再标出电子转移的方向和数目,在氧化还原反应中,化合价升高元素所在的反应物是还原剂;
(2)先找化合价变化的元素,再标出电子转移的方向和数目,化合价升高元素所在的反应物是还原剂,化合价降低元素所在的反应物是氧化剂;
(3)在氧化还原反应中,氧化剂的氧化性强于氧化产物的氧化性.
(2)先找化合价变化的元素,再标出电子转移的方向和数目,化合价升高元素所在的反应物是还原剂,化合价降低元素所在的反应物是氧化剂;
(3)在氧化还原反应中,氧化剂的氧化性强于氧化产物的氧化性.
解答:
解:(1)在反应:4Fe(OH)2+O2+2H2O=4Fe(OH)3中,铁元素化合价升高,失去电子,所以Fe(OH)2是还原剂,氧元素化合价降低,得到电子,电子转移情况如下:
 ,故答案为:
,故答案为: ;Fe(OH)2;
;Fe(OH)2;
(2)反应Cu+4HNO3 (浓)=Cu(NO3)2+2NO2↑+2H2O中,Cu元素化合价升高,失电子,是还原剂,氮元素化合价降低,得电子,硝酸只有一半氧化剂,电子转移的方向和数目如下: ,该反应的氧化剂和还原剂的物质的量之比为2:1,
,该反应的氧化剂和还原剂的物质的量之比为2:1,
故答案为: ;2:1;
;2:1;
(3)反应Fe+CuSO4=FeSO4+Cu中,铜离子是氧化剂,亚铁离子是氧化产物,氧化剂的氧化性强于氧化产物的氧化性,即金属阳离子的氧化性:Cu2+>Fe2+,故答案为:>.
 ,故答案为:
,故答案为: ;Fe(OH)2;
;Fe(OH)2;(2)反应Cu+4HNO3 (浓)=Cu(NO3)2+2NO2↑+2H2O中,Cu元素化合价升高,失电子,是还原剂,氮元素化合价降低,得电子,硝酸只有一半氧化剂,电子转移的方向和数目如下:
 ,该反应的氧化剂和还原剂的物质的量之比为2:1,
,该反应的氧化剂和还原剂的物质的量之比为2:1,故答案为:
 ;2:1;
;2:1;(3)反应Fe+CuSO4=FeSO4+Cu中,铜离子是氧化剂,亚铁离子是氧化产物,氧化剂的氧化性强于氧化产物的氧化性,即金属阳离子的氧化性:Cu2+>Fe2+,故答案为:>.
点评:本题综合考查学生氧化还原反应中氧化剂、还原剂的概念,电子转移以及线桥法表示电子转移的方向和数目知识,难度中等.

练习册系列答案
相关题目
氯气、溴蒸气分别与氢气反应的热化学方程式如下:
H2(g)+Cl2(g)═2HCl(g)△H1=-Q1kJ/mol
H2(g)+Br2(g)═2HBr(g)△H2=-Q2kJ/mol
已知Q1>Q2>0.
下列说法正确的是( )
H2(g)+Cl2(g)═2HCl(g)△H1=-Q1kJ/mol
H2(g)+Br2(g)═2HBr(g)△H2=-Q2kJ/mol
已知Q1>Q2>0.
下列说法正确的是( )
| A、上述两个反应中反应物的总能量均大于生成物的总能量 |
| B、上述两个反应中反应物的总能量均小于生成物的总能量 |
| C、H2(g)和Cl2(g)反应生成1 mol HCl(g)时放出Q1kJ的热量 |
| D、1molHBr(g)具有的能量大于1molHBr(l)具有的能量 |
科学家发现的C60是一种新的分子,它具有空心类足球的结构,被称为“足球分子”.最近科学家又确认存在着另一种“分子足球N60”,它与C60的结构相似,在高温或机械撞击时,其积蓄的巨大能量会在一瞬间释放出来.下列对于N60的说法中不正确的是( )
| A、N60易溶于水 |
| B、N60是N2的一种同素异形体 |
| C、等物质的量分解吸收的热量N60>N2 |
| D、N60是共价键结合的空心球状结构 |
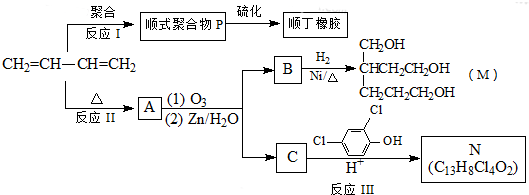
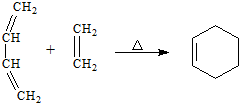
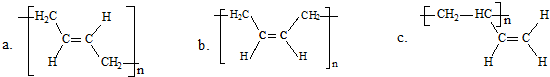
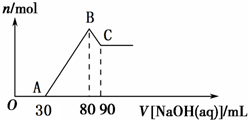 Ⅰ.短周期元素R被称为“生命元素”,R元素的最价高氧化物对应的水化物能与其气态氢化物化合生成盐A,写出生成A的化学方程式
Ⅰ.短周期元素R被称为“生命元素”,R元素的最价高氧化物对应的水化物能与其气态氢化物化合生成盐A,写出生成A的化学方程式 ⑤间甲基苯乙烯
⑤间甲基苯乙烯