题目内容
3.请将下列物质O3、KOH、KI、O2、I2、H2O组成一个自发的氧化还原反应,并配平,用单线桥标明电子转移情况.分析 臭氧具有极强的氧化性,所以臭氧作氧化剂,碘化钾是还原剂发生氧化还原反应,化学方程式为
2KI+O3+H2O═2KOH+I2+O2中,I元素的化合价升高,臭氧中O元素的化合价降低,以此来解答.
解答 解:臭氧具有极强的氧化性,所以臭氧作氧化剂,碘化钾是还原剂发生氧化还原反应,化学方程式为:2KI+O3+H2O═2KOH+I2+O2中,I元素的化合价升高,臭氧中O元素的化合价降低,整个反应中转移2mol的电子,单线桥标明电子转移情况为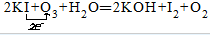 ,
,
故答案为: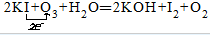 .
.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应的书写和转移电子的考查,题目难度不大.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
14.除去下列杂质(括号内的物质),下列做法不正确的是( )
| A. | NaCl固体(CaCl2):溶解,加Na2CO3溶液、过滤后加适量盐酸,最后蒸发结晶 | |
| B. | KCl固体(MnO2):溶解、过滤、蒸发结晶 | |
| C. | NaCl溶液(I2):加酒精,萃取、分液 | |
| D. | KNO3溶液(I2):加四氯化碳,萃取、分液 |
18.下列叙述不正确的是( )
| A. | CO2的摩尔质量是44g•mol-1,表示1molCO2的质量为44g | |
| B. | 硫酸溶液物质的量的浓度为1mol•L-1表示1L溶液中含有1mol硫酸 | |
| C. | 气体摩尔体积Vm≈22.4mol•L-1,表示1mol任何气体的体积都约为22.4L | |
| D. | 阿伏加德罗常数NA≈6.02×1023mol-1,表示1mol任何粒子集合体所含的粒子数约为6.02×1023 |
8.将质量比等于式量比的Na、Na2O、Na2O2、NaOH,分别投入等质量的足量水中,所得溶液质量分数最大的是( )
| A. | Na | B. | Na2O | C. | Na2O2 | D. | NaOH |
15.现有三组分散系:①汽油和氯化钠溶液 ②酒精的水溶液 ③碘单质的水溶液,分离以上各混合液的正确方法依次是( )
| A. | 分液、萃取、蒸馏 | B. | 分液、蒸馏、萃取 | C. | 萃取、蒸馏、分液 | D. | 蒸馏、萃取、分液 |
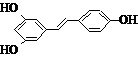 )属二苯乙烯类多酚化合物,具有抗氧化、抗癌和预防心血管疾病的作用.某课题组提出了如下合成路线:
)属二苯乙烯类多酚化合物,具有抗氧化、抗癌和预防心血管疾病的作用.某课题组提出了如下合成路线: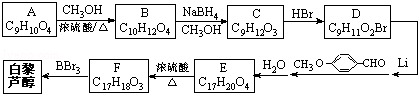

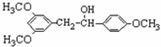 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$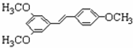 +H2O.
+H2O.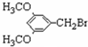 、E
、E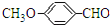 有多种同分异构体,写出符合下列条件的所有同分异构体的结构简式:
有多种同分异构体,写出符合下列条件的所有同分异构体的结构简式: .
. 乙醇是一种重要的有机化工原料,它可以用玉米、薯类等为原料经发酵、蒸馏制成.乙醇和汽油经加工处理形成的车用燃料即乙醇汽油.结合有关知识,回答下列问题:
乙醇是一种重要的有机化工原料,它可以用玉米、薯类等为原料经发酵、蒸馏制成.乙醇和汽油经加工处理形成的车用燃料即乙醇汽油.结合有关知识,回答下列问题: ;
; .
.