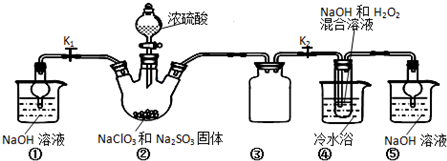
题目内容
18.下列叙述不正确的是( )| A. | CO2的摩尔质量是44g•mol-1,表示1molCO2的质量为44g | |
| B. | 硫酸溶液物质的量的浓度为1mol•L-1表示1L溶液中含有1mol硫酸 | |
| C. | 气体摩尔体积Vm≈22.4mol•L-1,表示1mol任何气体的体积都约为22.4L | |
| D. | 阿伏加德罗常数NA≈6.02×1023mol-1,表示1mol任何粒子集合体所含的粒子数约为6.02×1023 |
分析 A、CO2的摩尔质量是44g•mol-1,m=nM;
B、根据n=cV进行计算;
C、状况不知,则气体摩尔体积不知;
D、1mol的标准:含有阿伏加德罗常数个粒子的任何粒子集合体为1mol,约为:6.02×1023个.
解答 解:A、CO2的摩尔质量是44g•mol-1,根据m=nM=1mol×44g•mol-1=44g,故A正确;
B、n=cV=1mol•L-1×1L=1mol,故B正确;
C、状况不知,则气体摩尔体积不知,所以气体摩尔体积不定,故C错误;
D、1mol的标准为:含有阿伏加德罗常数个粒子的任何粒子集合体为1mol,约为:6.02×1023个,故D正确;
故选C.
点评 本题考查阿伏加德罗常数的有综合应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清气体摩尔体积与状况有关.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.实验室制取下列气体时,只能用排水法收集的是( )
| A. | CH4 | B. | CO2 | C. | NO | D. | NO2 |
9.若甲烷与氯气以物质的量之比1:3混合,在光照下得到的产物:(1)CH3Cl,(2)CH2Cl2,(3)CHCl3,(4)CCl4,其中正确的是( )
| A. | 只有(1) | B. | 只有(3) | C. | (1)(2)(3)的混合物 | D. | (1)(2)(3)(4)的混合物 |
10.将30mL0.5mol•L-1NaOH溶液加水稀释到500mL,NA表示阿伏伽德罗常数的值,关于稀释后溶液的叙述不正确的是( )
| A. | 溶液中OH-浓度为0.03mol•L-1 | |
| B. | 该溶液中含Na+个数为0.015NA | |
| C. | 向原溶液中加入470mL蒸馏水即可 | |
| D. | 该溶液中含有氧原子个数大于0.015NA |
10.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3- | |
| B. | 10 mol•L-1的浓氨水:Al3+、NH4+、NO3-、I- | |
| C. | 与Al反应放出H2的溶液:Mg2+、Ca2+、HCO3-、NO3- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液:K+、Na+、AlO2-、CO32- |
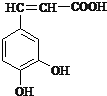 I、已知咖啡酸的结构如图所示.
I、已知咖啡酸的结构如图所示. ,A 的同分异构体中只有一种类型的氢原子的结构简式为C(CH3)2═C(CH3)2.
,A 的同分异构体中只有一种类型的氢原子的结构简式为C(CH3)2═C(CH3)2.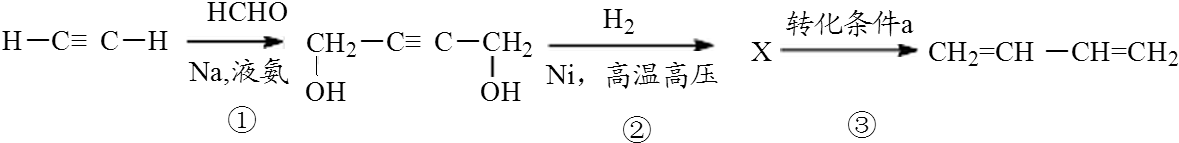
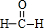 ,①的反应类型为加成反应,一定条件下,1,3-丁二烯反应生成的高分子结构简式为-[CH2-CH=CH-CH2]-n.
,①的反应类型为加成反应,一定条件下,1,3-丁二烯反应生成的高分子结构简式为-[CH2-CH=CH-CH2]-n.