题目内容
8.将质量比等于式量比的Na、Na2O、Na2O2、NaOH,分别投入等质量的足量水中,所得溶液质量分数最大的是( )| A. | Na | B. | Na2O | C. | Na2O2 | D. | NaOH |
分析 可以根据将等物质的量的①Na、②Na2O、③Na2O2、④NaOH中金属钠的量的多少来确定所得溶质的质量大小,并根据和水的反应情况结合溶液质量来确定溶质的质量分数关系.
解答 解:质量比等于式量比,即各物质的物质的量相同,
设4种物质的物质的量为amol,则Na2O2和Na2O都含有2molNa,所以这两种物质形成的溶液中溶质的物质的量浓度最大,并且Na2O2和水反应生成了O2,所以相当于Na2O,两者是等效的,即所得溶液质量分数相等,
等物质的量的Na质量比NaOH小,且金属钠和水反应生成H2,所以所得溶液质量分数Na>NaOH,即得到四种溶液中溶质的质量分数关系是Na2O=Na2O2>Na>NaOH,
故选BC.
点评 本题考查了溶液质量分数计算,题目难度不大,注意把握Na2O2和Na2O溶于水形成溶液时溶液质量分数的关系,侧重于考查学生的分析能力和对基础知识的综合应用能力.

练习册系列答案
相关题目
18.贮存粮食、水果的仓库内可用的保护气是( )
| A. | O2 | B. | N2 | C. | CO2 | D. | H2 |
13.如果向500mL含伪CaCl2和KCl的混合溶液中,加入含1mol碳酸钠的溶液,恰好使钙离子完全沉淀;如果向该溶液中加人含3mol硝酸银的溶液,恰好使氯离子完全沉淀.则该混合溶液中钾离子浓度为( )
| A. | 1mol•L-1 | B. | 2mol•L-1 | C. | 3mol•L-1 | D. | 4mol•L-1 |
3.强酸性溶液X中可能含有Na+、K+、NH4+、Fe2+、Al3+、CO32-、SO42-、Cl-中的若干种,某同学为了确认其成分,取溶液X进行连续实验,实验过程及产物如下:

下列结论正确的是( )

下列结论正确的是( )
| A. | X中肯定存在Na+、NH4+、Fe2+、Al3+、SO42- | |
| B. | 气体F经催化氧化可直接生成气体D | |
| C. | 沉淀C一定是BaSO4、沉淀G一定是Fe(OH)3、沉淀I一定是Al(OH)3 | |
| D. | X中不能确定的离子是Al3+、Na+、K+和Cl- |
20.表是元素周期表的一部分.
根据①~⑫元素在周期表中的位置,回答下列有关问题:(请用化学符号填写)
(1)写出下列元素符号:①N,⑥Si.
(2)在这些元素的最高价氧化物对应水化物中,酸性最强的是HClO4,呈两性的氢氧化物是Al(OH)3.(用化学式填写)
(3)在这些元素中单质的氧化性最强的是F2,还原性最强的是K.化学性质最不活泼的元素是Ar.(用化学式填写)
(4)用电子式表示⑦和⑩形成化合物的过程: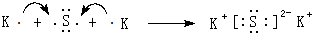 .
.
(5)⑦和⑧分别形成的气态氢化物中相对不稳定的是H2S.
根据①~⑫元素在周期表中的位置,回答下列有关问题:(请用化学符号填写)
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
(2)在这些元素的最高价氧化物对应水化物中,酸性最强的是HClO4,呈两性的氢氧化物是Al(OH)3.(用化学式填写)
(3)在这些元素中单质的氧化性最强的是F2,还原性最强的是K.化学性质最不活泼的元素是Ar.(用化学式填写)
(4)用电子式表示⑦和⑩形成化合物的过程:
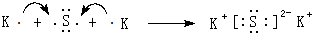 .
.(5)⑦和⑧分别形成的气态氢化物中相对不稳定的是H2S.
 是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二.
是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二. 无色,无气味并且易燃.是常见的一种化石能源.
无色,无气味并且易燃.是常见的一种化石能源. 有强氧化性的弱酸,见光易分解,具有漂白性,可以用于消毒杀菌.
有强氧化性的弱酸,见光易分解,具有漂白性,可以用于消毒杀菌.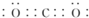 .
.

 ,在一定条件下Y与BrCl(一氯化溴,与卤素单质性质相似)按物质的量1:1发生加成反应,生成的产物可能有6种.
,在一定条件下Y与BrCl(一氯化溴,与卤素单质性质相似)按物质的量1:1发生加成反应,生成的产物可能有6种. .
.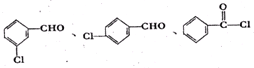 (不考虑立体异构).
(不考虑立体异构).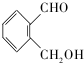 为有机原料制备化合物
为有机原料制备化合物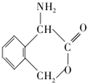 的合成路线流程图(无机试剂任选).
的合成路线流程图(无机试剂任选).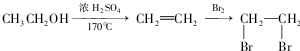 )
)