题目内容
 关于反应3A (g)+B (g)?2C (g) 发生过程中的能量变化如图,下列说法中不正确的是( )
关于反应3A (g)+B (g)?2C (g) 发生过程中的能量变化如图,下列说法中不正确的是( )| A、该反应为放热反应 |
| B、反应体系中加入催化剂,E1、E2减小,△H不变 |
| C、增大反应体系压强,化学平衡正向移动,气体B的浓度减少 |
| D、降低反应体系温度,反应速率减慢,A的转化率增大 |
考点:化学平衡的影响因素,反应热和焓变
专题:化学反应中的能量变化,化学平衡专题
分析:A.由图可知,反应物的总能量大于生成物的总能量;
B.催化剂降低反应所需的活化能,但不影响平衡移动,则反应热不变;
C.增大反应体系压强,反应体系中各物质的量浓度都变大,化学平衡正向移动,移动的结果气体B的浓度减少,但B的浓度比原来的大;
D.该反应为放热反应,降低温度,正逆反应速率均减小,平衡正向移动.
B.催化剂降低反应所需的活化能,但不影响平衡移动,则反应热不变;
C.增大反应体系压强,反应体系中各物质的量浓度都变大,化学平衡正向移动,移动的结果气体B的浓度减少,但B的浓度比原来的大;
D.该反应为放热反应,降低温度,正逆反应速率均减小,平衡正向移动.
解答:
解:A.由图可知,反应物的总能量大于生成物的总能量,则该反应为放热反应,故A正确;
B.催化剂降低反应所需的活化能,但不影响平衡移动,则反应热不变,则加入催化剂,E1、E2减小,△H不变,故B正确;
C.增大反应体系压强,反应体系中各物质的量浓度都变大,化学平衡正向移动,移动的结果气体B的浓度减少,但B的浓度比原来的大,故C错误;
D.该反应为放热反应,降低温度,正逆反应速率均减小,平衡正向移动,所以A的转化率增大,故D正确;
故选C.
B.催化剂降低反应所需的活化能,但不影响平衡移动,则反应热不变,则加入催化剂,E1、E2减小,△H不变,故B正确;
C.增大反应体系压强,反应体系中各物质的量浓度都变大,化学平衡正向移动,移动的结果气体B的浓度减少,但B的浓度比原来的大,故C错误;
D.该反应为放热反应,降低温度,正逆反应速率均减小,平衡正向移动,所以A的转化率增大,故D正确;
故选C.
点评:本题考查化学平衡移动的影响因素,为高频考点,把握图象分析及温度、催化剂、压强对平衡的影响为解答的关键,注意催化剂不能改变反应热,题目难度不大.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
在酸性高锰酸钾溶液中加入Na2O2粉末,高锰酸钾溶液会褪色,其中发生反应的离子方程式为:2MnO4-+16H++5Na2O2═2Mn2++5O2↑+8H2O+10Na+,下列判断正确的是( )
| A、Na2O2既是氧化剂,又是还原剂 |
| B、反应的氧化产物只有O2 |
| C、当反应产生标准状况下2.24LO2时,转移的电子为0.1mol |
| D、向高锰酸钾溶液中滴加浓盐酸可以得到酸性高锰酸钾溶液 |
NA代表阿伏加德罗常数,下列说法正确的是( )
| A、0.1molAlCl3完全水解转化为氢氧化铝胶体,生成0.1NA个胶粒 |
| B、28 g乙烯分子中含有极性共价键的数目为6NA |
| C、100mL18mol/L浓硫酸与足量的铜反应,生成SO2的分子数小于0.9NA |
| D、足量的铁与0.1molC12充分反应,转移的电子数为0.3NA |
臭氧是理想的烟气脱硝试剂,其脱硝反应为2NO2(g)+O3(g)═N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图象作出的判断正确的是( )
A、 升高温度,NO2的含量减小 |
B、 0~3 s内,反应速率为v(NO2)=0.2 mol?L-1 |
C、 t1时仅加入催化剂,平衡正向移动 |
D、 达平衡时,仅改变x,则x可能为压强 |
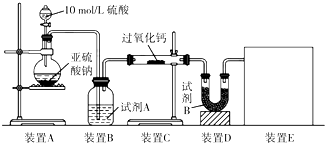 过氧化钙(CaO2)在日常生活和工农业生产中常用于种子消毒、药物制造、油脂漂白及鱼池增氧等.已知:过氧化钙与CO2反应有气体生成,而将SO2通入过氧化钙粉末中也有气体生成.有人提出CO2、SO2与过氧化钙的反应原理相同,但也有人提出SO2具有较强的还原性,CO2无强还原性,反应原理不相同.据此设计如下实验操作,通过测量气体的体积判断发生的化学反应,实验装置如图:
过氧化钙(CaO2)在日常生活和工农业生产中常用于种子消毒、药物制造、油脂漂白及鱼池增氧等.已知:过氧化钙与CO2反应有气体生成,而将SO2通入过氧化钙粉末中也有气体生成.有人提出CO2、SO2与过氧化钙的反应原理相同,但也有人提出SO2具有较强的还原性,CO2无强还原性,反应原理不相同.据此设计如下实验操作,通过测量气体的体积判断发生的化学反应,实验装置如图: