题目内容
设NA为阿伏伽德罗常数的数值,下列叙述正确的是( )
| A、已知N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol,在该反应中,当有3NA电子转移时,上述热化学反应方程式的焓变变为△H=46.2kJ/mol |
| B、1 L 0.1mol?L-1碳酸钠溶液的阴离子总数等于0.1 NA |
| C、室温下pH=13的NaOH溶液中含有的OH-0.1 NA |
| D、浓度分别为1 mol?L-1和 0.5mol?L-1的CH3COOH和CH3COONa 混合液共1L,含CH3COOH 和 CH3COO-共1.5 mol |
考点:阿伏加德罗常数
专题:
分析:A.焓变值与热化学方程式中各物质的计量数成正比,与反应物、生成物消耗的量无关;
B.碳酸根离子部分水解,导致溶液中碳酸根离子数目减少,阴离子数目增大;
C.缺少氢氧化钠溶液的体积,无法计算溶液中氢氧根离子的数目;
D.溶液中遵循物料守恒,根据混合液中的物料守恒进行计算.
B.碳酸根离子部分水解,导致溶液中碳酸根离子数目减少,阴离子数目增大;
C.缺少氢氧化钠溶液的体积,无法计算溶液中氢氧根离子的数目;
D.溶液中遵循物料守恒,根据混合液中的物料守恒进行计算.
解答:
解:A.热化学方程式N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol中的焓变为△H=-92.4kJ/mol,无论反应转移多少电子,该反应的焓变不会变化,故A错误;
B.1 L 0.1mol?L-1碳酸钠溶液中含有溶质碳酸钠0.1mol,由于碳酸根离子部分水解,则溶液中的碳酸根离子小于0.1mol,但是阴离子的物质的量大于0.1mol,阴离子总数大于0.1 NA,故B错误;
C.pH=13的氢氧化钠溶液的浓度为0.1mol/L,没有告诉溶液体积,无法计算溶液中氢氧根离子的物质的量及数目,故C错误;
D.1 mol?L-1和 0.5mol?L-1的CH3COOH和CH3COONa混合液共1L,含有的溶质醋酸和醋酸钠的物质的量分别为:1mol、0.5mol,根据物料守恒可知,混合液中含CH3COOH 和CH3COO-共:1mol+0.5mol=1.5 mol,故D正确;
故选D.
B.1 L 0.1mol?L-1碳酸钠溶液中含有溶质碳酸钠0.1mol,由于碳酸根离子部分水解,则溶液中的碳酸根离子小于0.1mol,但是阴离子的物质的量大于0.1mol,阴离子总数大于0.1 NA,故B错误;
C.pH=13的氢氧化钠溶液的浓度为0.1mol/L,没有告诉溶液体积,无法计算溶液中氢氧根离子的物质的量及数目,故C错误;
D.1 mol?L-1和 0.5mol?L-1的CH3COOH和CH3COONa混合液共1L,含有的溶质醋酸和醋酸钠的物质的量分别为:1mol、0.5mol,根据物料守恒可知,混合液中含CH3COOH 和CH3COO-共:1mol+0.5mol=1.5 mol,故D正确;
故选D.
点评:本题考查阿伏加德罗常数的综合应用,题目难度中等,注意掌握以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确热化学方程式的焓变的含义,选项B为易错点,注意碳酸根离子水解,溶液中阴离子数目增多.

练习册系列答案
相关题目
氮化铝(化学式为AlN,其中Al为+3价)广泛应用于电子、陶瓷等工业领域.在一定条件下,AlN可通过反应:Al2O3+N2+3C
2AlN+3CO合成.下列叙述正确的是( )
| ||
| A、上述反应中,N2是还原剂,Al2O3是氧化剂 |
| B、上述反应中,CO为还原产物,具有还原性 |
| C、上述反应中,每生成1 mol AlN需转移3 mol电子 |
| D、AlN的摩尔质量为41 g |
将过量的CO2分别通入:①CaCl2溶液 ②Na2SiO3溶液 ③Ca(ClO)2溶液 ④饱和Na2CO3溶液 ⑤NaAlO2溶液.最终有沉淀生成的是( )
| A、②④⑤ | B、②③⑤ |
| C、②⑤ | D、①②③④⑤ |
NA代表阿伏加德罗常数,下列说法正确的是( )
| A、0.1molAlCl3完全水解转化为氢氧化铝胶体,生成0.1NA个胶粒 |
| B、28 g乙烯分子中含有极性共价键的数目为6NA |
| C、100mL18mol/L浓硫酸与足量的铜反应,生成SO2的分子数小于0.9NA |
| D、足量的铁与0.1molC12充分反应,转移的电子数为0.3NA |
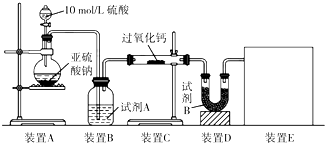 过氧化钙(CaO2)在日常生活和工农业生产中常用于种子消毒、药物制造、油脂漂白及鱼池增氧等.已知:过氧化钙与CO2反应有气体生成,而将SO2通入过氧化钙粉末中也有气体生成.有人提出CO2、SO2与过氧化钙的反应原理相同,但也有人提出SO2具有较强的还原性,CO2无强还原性,反应原理不相同.据此设计如下实验操作,通过测量气体的体积判断发生的化学反应,实验装置如图:
过氧化钙(CaO2)在日常生活和工农业生产中常用于种子消毒、药物制造、油脂漂白及鱼池增氧等.已知:过氧化钙与CO2反应有气体生成,而将SO2通入过氧化钙粉末中也有气体生成.有人提出CO2、SO2与过氧化钙的反应原理相同,但也有人提出SO2具有较强的还原性,CO2无强还原性,反应原理不相同.据此设计如下实验操作,通过测量气体的体积判断发生的化学反应,实验装置如图: