题目内容
下列物质属于电解质的是( )
| A、铜 |
| B、AgNO3 |
| C、蔗糖 |
| D、硫酸 |
考点:电解质与非电解质
专题:电离平衡与溶液的pH专题
分析:在水溶液里或融融状态下能导电的化合物是电解质,在水溶液里或熔融状态下都不能导电的化合物是非电解质,无论是电解质还是非电解质都必须是化合物,据此分析.
解答:
解:A.铜是单质不是化合物,所以铜既不是电解质也不是非电解质,故A错误;
B.在水溶液里或熔融态的硝酸银能导电,且硝酸银是化合物,所以硝酸银是电解质,故B正确;
C.蔗糖在水中以分子存在导致其水溶液不导电,但蔗糖是化合物,所以蔗糖是非电解质,故C错误;
D.H2SO4 在水中能电离出H+和SO42-在水溶液中能导电是电解质,故D正确;
故选BD.
B.在水溶液里或熔融态的硝酸银能导电,且硝酸银是化合物,所以硝酸银是电解质,故B正确;
C.蔗糖在水中以分子存在导致其水溶液不导电,但蔗糖是化合物,所以蔗糖是非电解质,故C错误;
D.H2SO4 在水中能电离出H+和SO42-在水溶液中能导电是电解质,故D正确;
故选BD.
点评:本题考查了电解质的判断,题目难度不大,注意电解质和非电解质的区别,注意无论是电解质还是非电解质都必须是化合物.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案
相关题目
粗食盐的杂质主要是MgCl2.为了除去杂质,工业上常把粗盐粉碎后用饱和食盐水浸洗,再过滤出食盐.对此,下面的评论正确的是( )
| A、浸洗前后,被浸洗的食盐中MgCl2的含量基本不变 |
| B、用来浸洗的饱和食盐水在浸洗前后没有变化 |
| C、浸洗用过的饱和食盐水可以无限次地使用下去 |
| D、粉碎颗粒的大小影响浸洗后盐中MgCl2的含量 |
在2A(g)+3B(g)=C(g)+4D(g)的反应中,下列表示该反应的化学反应速度最快的是( )
| A、v (A)=0.5 mol/(L?s) |
| B、v (B)=0.9 mol/(L?s) |
| C、v (C)=0.8 mol/(L?s) |
| D、v (D)=1.0 mol/(L?s) |
氮化铝(化学式为AlN,其中Al为+3价)广泛应用于电子、陶瓷等工业领域.在一定条件下,AlN可通过反应:Al2O3+N2+3C
2AlN+3CO合成.下列叙述正确的是( )
| ||
| A、上述反应中,N2是还原剂,Al2O3是氧化剂 |
| B、上述反应中,CO为还原产物,具有还原性 |
| C、上述反应中,每生成1 mol AlN需转移3 mol电子 |
| D、AlN的摩尔质量为41 g |
下列说法正确的是( )
| A、其他条件不变,增大某一反应物浓度,反应物的转化率一定都增大 |
| B、对于有气体参加的反应,其他条件不变增大压强,体积缩小,体系中各气体的浓度一定增大 |
| C、对于有气体参加的反应,改变压强使平衡向右移动,生成的气体的浓度一定增大 |
| D、增大反应物的浓度,平衡向右移动,生成物的体积分数一定增大 |
在酸性高锰酸钾溶液中加入Na2O2粉末,高锰酸钾溶液会褪色,其中发生反应的离子方程式为:2MnO4-+16H++5Na2O2═2Mn2++5O2↑+8H2O+10Na+,下列判断正确的是( )
| A、Na2O2既是氧化剂,又是还原剂 |
| B、反应的氧化产物只有O2 |
| C、当反应产生标准状况下2.24LO2时,转移的电子为0.1mol |
| D、向高锰酸钾溶液中滴加浓盐酸可以得到酸性高锰酸钾溶液 |
NA代表阿伏加德罗常数,下列说法正确的是( )
| A、0.1molAlCl3完全水解转化为氢氧化铝胶体,生成0.1NA个胶粒 |
| B、28 g乙烯分子中含有极性共价键的数目为6NA |
| C、100mL18mol/L浓硫酸与足量的铜反应,生成SO2的分子数小于0.9NA |
| D、足量的铁与0.1molC12充分反应,转移的电子数为0.3NA |
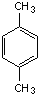 可命名为
可命名为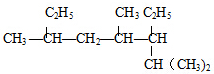 的系统命名为
的系统命名为