题目内容
用短线“-”表示共用电子对,用“‥”表示未成键孤对电子的式子叫路易斯结构式.R分子的路易斯结构式可以表示为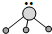 ,则以下叙述错误的是( )
,则以下叙述错误的是( )
 ,则以下叙述错误的是( )
,则以下叙述错误的是( )| A、R为三角锥形 |
| B、R可以是BF3 |
| C、R是极性分子 |
| D、键角小于109°28′ |
考点:判断简单分子或离子的构型
专题:化学键与晶体结构
分析:A、根据价层电子对互斥理论判断;
B、BF3中B原子没有孤对电子;
C、由极性键构成的分子,若结构对称,正负电荷的中心重合,则为非极性分子;
D、三角锥形分子的键角为107°.
B、BF3中B原子没有孤对电子;
C、由极性键构成的分子,若结构对称,正负电荷的中心重合,则为非极性分子;
D、三角锥形分子的键角为107°.
解答:
解:A、在 中含有3个单键和1个孤电子对,价层电子对数为4,而且含有1个孤电子对,空间上为三角锥形,故A正确;
中含有3个单键和1个孤电子对,价层电子对数为4,而且含有1个孤电子对,空间上为三角锥形,故A正确;
B、B原子最外层含有3个电子,BF3中B原子形成3个共价键,B原子没有孤对电子,所以R不是BF3,故B错误;
C、由极性键构成的分子,若结构对称,正负电荷的中心重合,则为非极性分子,R分子的结构不对称,R是极性分子,故C正确;
D、三角锥形分子的键角为107°,键角小于109°28′,故D正确;
故选B.
 中含有3个单键和1个孤电子对,价层电子对数为4,而且含有1个孤电子对,空间上为三角锥形,故A正确;
中含有3个单键和1个孤电子对,价层电子对数为4,而且含有1个孤电子对,空间上为三角锥形,故A正确;B、B原子最外层含有3个电子,BF3中B原子形成3个共价键,B原子没有孤对电子,所以R不是BF3,故B错误;
C、由极性键构成的分子,若结构对称,正负电荷的中心重合,则为非极性分子,R分子的结构不对称,R是极性分子,故C正确;
D、三角锥形分子的键角为107°,键角小于109°28′,故D正确;
故选B.
点评:本题是一道信息题,考查学生对题干信息的理解和应用能力,侧重于对基础知识的综合运用的考查,难度一般.

练习册系列答案
相关题目
下列离子方程式书写正确的是:( )
| A、硫酸亚铁加过氧化氢溶液:Fe2++H2O2+2H+═Fe3++4H2O |
| B、将少量硝酸银溶液滴入氨水中:Ag++2NH3?H2O═[Ag(NH3)2]++2H2O |
| C、KAl(SO4)2中滴加Ba(OH)2使SO42-恰好完全沉淀2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ |
| D、铝粉与NaOH的D2O溶液反应:2Al+2OH-+2D2O═2AlO2-+H2↑+2D2↑ |
下列有关物质的性质或应用均正确的是( )
| A、Si是一种非金属主族元素,其氧化物可用于制作计算机芯片 |
| B、氢氧化镁分解时吸收大量的热量,添加到合成树脂中可作阻燃剂 |
| C、铁具有良好的导电性,氯碱工业中可用铁作阳极电解食盐水 |
| D、用二氧化硫加工银耳,使之更白 |
下列说法中正确的是( )
| A、凡是放热反应都是自发的,吸热反应都是非自发的 |
| B、非自发反应在任何条件下都不能实现 |
| C、熵增加且放热的反应一定是自发反应 |
| D、自发反应一定是熵增大,非自发反应一定是熵减小或不变 |
关于下列四个图象的说法正确的是( )


| A、已知图①是体系Fe3+(aq)+SCN-(aq)?Fe(SCN)2+(aq)中的c[Fe(SCN)2+]与温度T的平衡图象.A点与B点相比,A点的c(Fe3+)大 |
| B、图②表示镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积V与时间t 的关系.则反应中镁和铝的反应速率之比为2:3 |
| C、图③表示电源X极为正极,U形管中为AgNO3溶液,则b管中电极反应式是:4OH--4e-=O2↑+2H2O |
| D、图④是某温度下,相同体积,相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积V变化的曲线.Ⅱ为醋酸稀释时pH的变化曲线,且a、b两点水的电离程度:a<b |
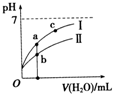 已知下表为250C时某些弱酸的电离平衡常数.如图表示常温时,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.依据所给信息,下列说法正确的是( )
已知下表为250C时某些弱酸的电离平衡常数.如图表示常温时,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.依据所给信息,下列说法正确的是( )| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
| A、相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:C(Na+)>C(ClO-)>C(CH3COO-)>C(OH-)>C(H+) |
| B、向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O═2HClO+CO32- |
| C、a、b、c三点所示溶液中水的电离程度c>a>b |
| D、图象中,I表示CH3COOH,Ⅱ表示HClO,且溶液导电性:c>b>a |
将0.1mol/L的醋酸钠溶液20mL与0.1mol/L盐酸10mL混合后,溶液显酸性,则溶液中有关微粒的浓度关系正确的是( )
| A、c(Ac-)>c(Cl-)>c(H+)>c(HAc) |
| B、c(Na+)+c(H+)=c(Ac-)+c(Cl-) |
| C、c(Ac-)=c(Cl-)>c(H+)>c(HAc) |
| D、c(Ac-)>c(Cl-)>c(HAc)>c(H+) |
下列说法正确的是( )
| A、焊锡(锡铅合金)熔点比金属锡高 |
| B、油脂的皂化反应生成脂肪酸和甘油 |
| C、焰火的五彩缤纷是某些金属元素的性质的展现 |
| D、NaFeO4自身处理水的原理与明矾和漂白粉共同处理水的原理不同 |