题目内容
下列有关物质的性质或应用均正确的是( )
| A、Si是一种非金属主族元素,其氧化物可用于制作计算机芯片 |
| B、氢氧化镁分解时吸收大量的热量,添加到合成树脂中可作阻燃剂 |
| C、铁具有良好的导电性,氯碱工业中可用铁作阳极电解食盐水 |
| D、用二氧化硫加工银耳,使之更白 |
考点:硅和二氧化硅,二氧化硫的化学性质,镁、铝的重要化合物,铁的化学性质
专题:元素及其化合物,化学应用
分析:A、计算机芯片的原料是晶体硅;
B、根据灭火的原理,以及氢氧化镁在380℃时,分解放出水蒸气和耐高温的固体氧化镁这一性质回答.分解过程中吸收大量的热,水蒸气能稀释氧气,氧化镁固体能隔绝氧气或空气;
C、氯碱工业中可用铁作阳极电解食盐水,阳极铁失电子生成亚铁离子;
D、二氧化硫是有毒气体;
B、根据灭火的原理,以及氢氧化镁在380℃时,分解放出水蒸气和耐高温的固体氧化镁这一性质回答.分解过程中吸收大量的热,水蒸气能稀释氧气,氧化镁固体能隔绝氧气或空气;
C、氯碱工业中可用铁作阳极电解食盐水,阳极铁失电子生成亚铁离子;
D、二氧化硫是有毒气体;
解答:
解;A、Si是一种非金属主族元素,硅晶体可用于制作计算机芯片,其氧化物二氧化硅是光导纤维的原料,故A错误;
B、阻燃物质原理有三个:清除可燃物、隔绝氧气或空气、使可燃物的温度降到着火点以下,三者具其一即可,氢氧化镁在380℃时分解,方程式为:Mg(OH)2MgO+H2O↑.氢氧化镁分解过程中吸收大量的热,能使可燃物的温度降到着火点以下,反应生成的水蒸气能稀释可燃物表面的氧气,生成氧化镁固体能隔绝氧气或空气,故B正确;
C、氯碱工业中为增强导电性,阳极是石墨,溶液中氢氧根离子失电子发生氧化反应,用铁作阴极电解食盐水,得到氢气、氯气和氢氧化钠,故C错误;
D、二氧化硫是有毒气体,不能用二氧化硫加工银耳漂白,故D错误;
故选B.
B、阻燃物质原理有三个:清除可燃物、隔绝氧气或空气、使可燃物的温度降到着火点以下,三者具其一即可,氢氧化镁在380℃时分解,方程式为:Mg(OH)2MgO+H2O↑.氢氧化镁分解过程中吸收大量的热,能使可燃物的温度降到着火点以下,反应生成的水蒸气能稀释可燃物表面的氧气,生成氧化镁固体能隔绝氧气或空气,故B正确;
C、氯碱工业中为增强导电性,阳极是石墨,溶液中氢氧根离子失电子发生氧化反应,用铁作阴极电解食盐水,得到氢气、氯气和氢氧化钠,故C错误;
D、二氧化硫是有毒气体,不能用二氧化硫加工银耳漂白,故D错误;
故选B.
点评:本题考查了硅及其化合物、氧化镁、氯碱工业、二氧化硫性质和原理的理解应用,掌握基础是关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
己知:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-25kJ?mol-1.某温度下的平衡常数为400.此温度下,在1L体积不变的密闭容器中加入CH3OH,某时刻测得各组分的物质的量浓度如表,下列说法中不正确的是( )
| 物质 | CH3OH | CH3OCH3 | H2O |
| c/(mol?L-1) | 0.08 | 1.6 | 1.6 |
| A、此时刻反应达到平衡状态 |
| B、容器内压强不变时,说明反应达平衡状态 |
| C、平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率不变 |
| D、平衡时,反应混合物的总能量降低40kJ |
在3种不同条件下,分别向容积为2L的恒容密闭容器中充入2mol A和1mol B,发生反应如下:2A(g)+B(g)?2D(g)△H=-QKJ?mol-1.相关条件和数据见如表,下列说法正确的是( )
| 实验编号 | 实验Ⅰ | 实验Ⅱ | 实验Ⅲ |
| 反应温度/℃ | 800 | 800 | 850 |
| 达平衡时间/min | 40 | 10 | 30 |
| c(D)平衡/mol?L-1 | 0.5 | 0.5 | 0.15 |
| 反应的能量变化/KJ | Q1 | Q2 | Q3 |
| A、可用压强或密度是否发生变化判断上述反应是否达到平衡 |
| B、实验Ⅱ可能隐含的条件是使用催化剂,实验Ⅲ达平衡时υ(D)为0.01mol?L-1?min-1 |
| C、由表中信息可知Q>O,并显有Q3<Q2=Q1=Q |
| D、实验Ⅰ达平衡后,恒温下再向容器中通入1mol A和1mol D,达平衡时c(D)为1.0mol?L-1 |
金银花中能提取出有很高药用价值的绿原酸(如图),下列判断正确的是( )
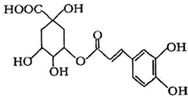

| A、分子中有可能所有碳原子共平面 |
| B、分子式为C16H18O9 |
| C、分子中含有醚键 |
| D、分子中有4个手性碳原子 |
下列说法错误的是( )
| A、同系物一定符合同一通式 |
| B、同分异构体一定具有相同的最简式 |
| C、相对分子质量相等的两种有机物必定是同分异构体 |
| D、同分异构体间不一定有相似的化学性质 |
形成物质世界多样性的原因有( )
①元素种类;②同位素;③成键方式;④同素异形现象;⑤反应现象.
①元素种类;②同位素;③成键方式;④同素异形现象;⑤反应现象.
| A、①③④⑤ | B、①②④⑤ |
| C、①②③④ | D、①②③④⑤ |
用短线“-”表示共用电子对,用“‥”表示未成键孤对电子的式子叫路易斯结构式.R分子的路易斯结构式可以表示为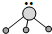 ,则以下叙述错误的是( )
,则以下叙述错误的是( )
 ,则以下叙述错误的是( )
,则以下叙述错误的是( )| A、R为三角锥形 |
| B、R可以是BF3 |
| C、R是极性分子 |
| D、键角小于109°28′ |
X、Y、Z、W是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,己是由Z元素形成的单质.已知:甲+乙=丁+己,甲+丙=戊+己;0.1mol?L-1丁溶液的pH为13(25℃).下列说法正确的是( )
| A、1 mol甲与足量的乙完全反应共转移了1 mol电子 |
| B、Y元素在周期表中的位置为第三周期第ⅣA族 |
| C、原子半径:W>Z>Y>X |
| D、1.0 L 0.1 mol?L-1戊溶液中阴离子总的物质的量小于0.1 mol |