题目内容
将0.1mol/L的醋酸钠溶液20mL与0.1mol/L盐酸10mL混合后,溶液显酸性,则溶液中有关微粒的浓度关系正确的是( )
| A、c(Ac-)>c(Cl-)>c(H+)>c(HAc) |
| B、c(Na+)+c(H+)=c(Ac-)+c(Cl-) |
| C、c(Ac-)=c(Cl-)>c(H+)>c(HAc) |
| D、c(Ac-)>c(Cl-)>c(HAc)>c(H+) |
考点:离子浓度大小的比较,弱电解质在水溶液中的电离平衡,盐类水解的应用
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:二者混合后,溶液中的溶质是等物质的量浓度的CH3COONa、NaCl、CH3COOH,溶液呈酸性,说明CH3COOH的电离程度大于Ac-的水解程度,溶液中存在电荷守恒、物料守恒,据此分析解答.
解答:
解:二者混合后,溶液中的溶质是等物质的量浓度的CH3COONa、NaCl、CH3COOH,溶液呈酸性,说明CH3COOH的电离程度大于Ac-的水解程度,
A.混合溶液中的溶质是等物质的量浓度的CH3COONa、NaCl、CH3COOH,溶液呈酸性,说明CH3COOH的电离程度大于Ac-的水解程度,但醋酸的电离程度较小,所以c(H+)<c(HAc),故A错误;
B.混合溶液中存在电荷守恒c(Na+)+c(H+)=c(Ac-)+c(Cl-)+c(OH-),故B错误;
C.混合溶液中的溶质是等物质的量浓度的CH3COONa、NaCl、CH3COOH,溶液呈酸性,说明CH3COOH的电离程度大于Ac-的水解程度,所以c(Ac-)>c(Cl-),故C错误;
D.混合溶液中的溶质是等物质的量浓度的CH3COONa、NaCl、CH3COOH,溶液呈酸性,说明CH3COOH的电离程度大于Ac-的水解程度,所以c(Ac-)>c(Cl-),HAc的电离程度较小,所以c(HAc)>c(H+),故D正确;
故选D.
A.混合溶液中的溶质是等物质的量浓度的CH3COONa、NaCl、CH3COOH,溶液呈酸性,说明CH3COOH的电离程度大于Ac-的水解程度,但醋酸的电离程度较小,所以c(H+)<c(HAc),故A错误;
B.混合溶液中存在电荷守恒c(Na+)+c(H+)=c(Ac-)+c(Cl-)+c(OH-),故B错误;
C.混合溶液中的溶质是等物质的量浓度的CH3COONa、NaCl、CH3COOH,溶液呈酸性,说明CH3COOH的电离程度大于Ac-的水解程度,所以c(Ac-)>c(Cl-),故C错误;
D.混合溶液中的溶质是等物质的量浓度的CH3COONa、NaCl、CH3COOH,溶液呈酸性,说明CH3COOH的电离程度大于Ac-的水解程度,所以c(Ac-)>c(Cl-),HAc的电离程度较小,所以c(HAc)>c(H+),故D正确;
故选D.
点评:本题考查了离子浓度大小比较,根据溶液中的溶质、溶液酸碱性再结合电荷守恒来分析解答,注意Ac-、Cl-、HAc浓度大小关系,题目难度中等.

练习册系列答案
相关题目
己知:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-25kJ?mol-1.某温度下的平衡常数为400.此温度下,在1L体积不变的密闭容器中加入CH3OH,某时刻测得各组分的物质的量浓度如表,下列说法中不正确的是( )
| 物质 | CH3OH | CH3OCH3 | H2O |
| c/(mol?L-1) | 0.08 | 1.6 | 1.6 |
| A、此时刻反应达到平衡状态 |
| B、容器内压强不变时,说明反应达平衡状态 |
| C、平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率不变 |
| D、平衡时,反应混合物的总能量降低40kJ |
形成物质世界多样性的原因有( )
①元素种类;②同位素;③成键方式;④同素异形现象;⑤反应现象.
①元素种类;②同位素;③成键方式;④同素异形现象;⑤反应现象.
| A、①③④⑤ | B、①②④⑤ |
| C、①②③④ | D、①②③④⑤ |
用短线“-”表示共用电子对,用“‥”表示未成键孤对电子的式子叫路易斯结构式.R分子的路易斯结构式可以表示为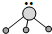 ,则以下叙述错误的是( )
,则以下叙述错误的是( )
 ,则以下叙述错误的是( )
,则以下叙述错误的是( )| A、R为三角锥形 |
| B、R可以是BF3 |
| C、R是极性分子 |
| D、键角小于109°28′ |
下列对有机物的叙述中不正确的是( )
| A、邻二氯苯不存在同分异构体说明苯分子中6个碳原子之间的键是完全相同 | ||||
B、若乙酸分子中的O 都是
| ||||
| C、只用溴水就可以鉴别己烯、乙酸、苯、溴苯四种无色溶液或液体 | ||||
| D、硝基、羟基、乙基等都是官能团 |
汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3═K2O+5Na2O+16N2↑.若1mol KNO3反应,则下列说法正确的是( )
| A、N2是还原产物 |
| B、KNO3被氧化 |
| C、转移电子的物质的量为5 mol |
| D、被氧化的N原子的物质的量为1 mol |
X、Y、Z、W是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,己是由Z元素形成的单质.已知:甲+乙=丁+己,甲+丙=戊+己;0.1mol?L-1丁溶液的pH为13(25℃).下列说法正确的是( )
| A、1 mol甲与足量的乙完全反应共转移了1 mol电子 |
| B、Y元素在周期表中的位置为第三周期第ⅣA族 |
| C、原子半径:W>Z>Y>X |
| D、1.0 L 0.1 mol?L-1戊溶液中阴离子总的物质的量小于0.1 mol |
 某化学研究小组探究溴化亚铁水溶液与氯气反应.
某化学研究小组探究溴化亚铁水溶液与氯气反应.