题目内容
下列说法正确的是( )
| A、焊锡(锡铅合金)熔点比金属锡高 |
| B、油脂的皂化反应生成脂肪酸和甘油 |
| C、焰火的五彩缤纷是某些金属元素的性质的展现 |
| D、NaFeO4自身处理水的原理与明矾和漂白粉共同处理水的原理不同 |
考点:金属与合金在性能上的主要差异,盐类水解的应用,焰色反应,油脂的性质、组成与结构
专题:元素及其化合物
分析:A.合金的熔点低于组成合金的各组分金属的熔点;
B.油脂的皂化反应是指:油脂在碱性条件下水解生成高级脂肪酸盐和甘油;
C.某些金属或它们的化合物在无色火焰中灼烧时使火焰呈现特征的颜色的反应;
D.漂白粉和NaFeO4都具有强的氧化性,处理水时可以杀菌消毒;NaFeO4被还原生成的三价铁离子与明矾电离出的铝离子水解分别生成氢氧化铁胶体和氢氧化铝胶体,二者具有吸附性能吸收水中的杂质颗粒,起到净水的作用.
B.油脂的皂化反应是指:油脂在碱性条件下水解生成高级脂肪酸盐和甘油;
C.某些金属或它们的化合物在无色火焰中灼烧时使火焰呈现特征的颜色的反应;
D.漂白粉和NaFeO4都具有强的氧化性,处理水时可以杀菌消毒;NaFeO4被还原生成的三价铁离子与明矾电离出的铝离子水解分别生成氢氧化铁胶体和氢氧化铝胶体,二者具有吸附性能吸收水中的杂质颗粒,起到净水的作用.
解答:
解:A.合金的熔点低于组成合金的各组分金属的熔点,故A错误;
B.油脂的皂化反应生成脂肪酸钠和甘油,故B错误;
C.某些金属或它们的化合物在无色火焰中灼烧时使火焰呈现特征的颜色的反应,故C正确;
D.白粉和NaFeO4都具有强的氧化性,处理水时可以杀菌消毒;NaFeO4被还原生成的三价铁离子与明矾电离出的铝离子水解分别生成氢氧化铁胶体和氢氧化铝胶体,二者具有吸附性能吸收水中的杂质颗粒,起到净水的作用,所以NaFeO4自身处理水的原理与明矾和漂白粉共同处理水的原理相同,故D错误;
故选:C.
B.油脂的皂化反应生成脂肪酸钠和甘油,故B错误;
C.某些金属或它们的化合物在无色火焰中灼烧时使火焰呈现特征的颜色的反应,故C正确;
D.白粉和NaFeO4都具有强的氧化性,处理水时可以杀菌消毒;NaFeO4被还原生成的三价铁离子与明矾电离出的铝离子水解分别生成氢氧化铁胶体和氢氧化铝胶体,二者具有吸附性能吸收水中的杂质颗粒,起到净水的作用,所以NaFeO4自身处理水的原理与明矾和漂白粉共同处理水的原理相同,故D错误;
故选:C.
点评:本题考查了合金的性质,焰色反应的定义,油脂、NaFeO4、漂白粉、明矾的性质,题目难度不大,注意D选项,抓住NaFeO4具有强的氧化性和被还原生成三价铁离子水解生成氢氧化铁的性质是解题的关键.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
在3种不同条件下,分别向容积为2L的恒容密闭容器中充入2mol A和1mol B,发生反应如下:2A(g)+B(g)?2D(g)△H=-QKJ?mol-1.相关条件和数据见如表,下列说法正确的是( )
| 实验编号 | 实验Ⅰ | 实验Ⅱ | 实验Ⅲ |
| 反应温度/℃ | 800 | 800 | 850 |
| 达平衡时间/min | 40 | 10 | 30 |
| c(D)平衡/mol?L-1 | 0.5 | 0.5 | 0.15 |
| 反应的能量变化/KJ | Q1 | Q2 | Q3 |
| A、可用压强或密度是否发生变化判断上述反应是否达到平衡 |
| B、实验Ⅱ可能隐含的条件是使用催化剂,实验Ⅲ达平衡时υ(D)为0.01mol?L-1?min-1 |
| C、由表中信息可知Q>O,并显有Q3<Q2=Q1=Q |
| D、实验Ⅰ达平衡后,恒温下再向容器中通入1mol A和1mol D,达平衡时c(D)为1.0mol?L-1 |
用短线“-”表示共用电子对,用“‥”表示未成键孤对电子的式子叫路易斯结构式.R分子的路易斯结构式可以表示为 ,则以下叙述错误的是( )
,则以下叙述错误的是( )
 ,则以下叙述错误的是( )
,则以下叙述错误的是( )| A、R为三角锥形 |
| B、R可以是BF3 |
| C、R是极性分子 |
| D、键角小于109°28′ |
下列对有机物的叙述中不正确的是( )
| A、邻二氯苯不存在同分异构体说明苯分子中6个碳原子之间的键是完全相同 | ||||
B、若乙酸分子中的O 都是
| ||||
| C、只用溴水就可以鉴别己烯、乙酸、苯、溴苯四种无色溶液或液体 | ||||
| D、硝基、羟基、乙基等都是官能团 |
汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3═K2O+5Na2O+16N2↑.若1mol KNO3反应,则下列说法正确的是( )
| A、N2是还原产物 |
| B、KNO3被氧化 |
| C、转移电子的物质的量为5 mol |
| D、被氧化的N原子的物质的量为1 mol |
有机物X的结构如下,下列说法正确的是( )
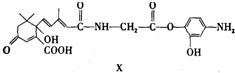

| A、X能发生氧化、取代、酯化、加聚、缩聚反应 |
| B、X与FeCl3溶液不能发生显色反应 |
| C、1mol X与足量NaOH溶液反应,最多消耗2mol NaOH |
| D、X的分子式为C23H26N2O7 |
X、Y、Z、W是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,己是由Z元素形成的单质.已知:甲+乙=丁+己,甲+丙=戊+己;0.1mol?L-1丁溶液的pH为13(25℃).下列说法正确的是( )
| A、1 mol甲与足量的乙完全反应共转移了1 mol电子 |
| B、Y元素在周期表中的位置为第三周期第ⅣA族 |
| C、原子半径:W>Z>Y>X |
| D、1.0 L 0.1 mol?L-1戊溶液中阴离子总的物质的量小于0.1 mol |
排放到大气的物质往往对环境有利弊二重性.下列相关叙述与事实不符的是( )
| A、植物光合作用需要CO2,但是大气中CO2过多引起温室效应会导致气候恶化 |
| B、汽车尾气中的NO会污染城市空气,雷电产生的NO会转化为NO3- 并随雨水滋养地表植物 |
| C、臭氧层中的O3可以吸收宇宙射线福佑生灵,地表上的O3却可能伤害人的呼吸道 |
| D、少量Cl2可用于水体净化消毒,大量Cl2会导致水体富营养化 |
