题目内容
14.安全气囊是行车安全的重要设施.当车辆发生碰撞的瞬间,安全装置通电点火使其中的粉末分解释放出大量的氮气形成气囊,从而保护司机及乘客.为研究安全气囊工作的化学原理,取安全装置中的粉末进行研究.经实验分析,确定该粉末是一种混合物且只含Na、Fe、N、0四种元素.(1)铁元素在元素周期表中的位置是第四周期、第Ⅷ族,Na原子结构示意图为
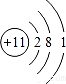 ,其中三种主族元素的离子半径从大到小的顺序是N3->O2->Na+ (用离子符号表示)
,其中三种主族元素的离子半径从大到小的顺序是N3->O2->Na+ (用离子符号表示)(2)水溶性实验表明,安全气囊中固体粉末部分溶解.不溶物为一种红棕色固体,可溶于盐酸.已知该不溶物能发生铝热反应,写出反应的化学方程式2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe.
(3)氮的最高价氧化物对应的水化物与其氢化物反应生成一种盐,该盐晶体中含有的化学键类型是离子键、共价键
(4)有一种液态氮氢化合物,分子中氮与氢两种元素的质量比为7:1,是“神舟七号”飞船发射时使用的高能燃料之一,结构分析发现该分子结构中只有单键,与氨相似,则其的结构式为
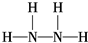
已知8g液态液态氮氢化合物与液态双氧水恰好完全反应,产生两种无毒又不污染环境的气态物质,放出375kJ的热量,写出该反应的热化学方程式N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-1500kJ/mol.
分析 (1)铁为26号元素位于第四周期第Ⅷ族;
Na元素原子核外有11个电子,有3个电子层,由里到外各层电子数依次为2、8、1;
电子层结构相同,核电荷数越大离子半径越小;
(2)不溶物为一种红棕色固体,可溶于盐酸,该不溶物能发生铝热反应,则红棕色不溶物为氧化铁,氧化铁与铝发生铝热反应生成氧化铝与铁;
(3)氮的最高价氧化物对应的水化物与其氢化物反应生成一种盐,该盐为NH4NO3,含有离子键、共价键;
(4)有一种液态氮氢化合物戊,分子中氮与氢两种元素的质量比为7:1,分子中N、H原子数目之比为$\frac{7}{14}$:$\frac{1}{1}$=2:1,则戊为N2H4;液态戊与液态双氧水恰好完全反应,产生两种无毒又不污染环境的气态物质,应生成氮气与水,8gN2H4的物质的量为$\frac{8g}{32g/mol}$=0.25mol,1molN2H4反应放出的热量为375kJ×$\frac{1mol}{0.25mol}$=1500kJ,标注物质聚集状态和对应反应的焓变写出热化学方程式.
解答 解:(1)铁为26号元素位于第四周期第Ⅷ族;
Na元素原子核外有11个电子,有3个电子层,由里到外各层电子数依次为2、8、1,原子结构示意图为 ;
;
N3-、O2-、Na+电子层结构相同,核电荷数越大离子半径越小,故离子半径N3->O2->Na+,
故答案为:第四周期第Ⅷ族; ;N3->O2->Na+;
;N3->O2->Na+;
(2)不溶物为一种红棕色固体,可溶于盐酸,该不溶物能发生铝热反应,则红棕色不溶物为氧化铁,氧化铁与铝发生铝热反应生成氧化铝与铁,反应方程式为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,
故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe;
(3)氮的最高价氧化物对应的水化物与其氢化物反应生成一种盐,该盐为NH4NO3,含有离子键、共价键;
故答案为:离子键、共价键;
(4)有一种液态氮氢化合物,分子中氮与氢两种元素的质量比为7:1,分子中N、H原子数目之比为$\frac{7}{14}$:$\frac{1}{1}$=2:1,则为N2H4,该分子结构中只有单键,与氨相似,则N原子之间形成1对共用电子对,N原子与H原子之间形成1对共用电子对,其结构式为: ,液态戊与液态双氧水恰好完全反应,产生两种无毒又不污染环境的气态物质,应生成氮气与水,8gN2H4的物质的量为$\frac{8g}{32g/mol}$=0.25mol,1molN2H4反应放出的热量为375kJ×$\frac{1mol}{0.25mol}$=1500kJ,反应热化学方程式为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-1500 kJ/mol,
,液态戊与液态双氧水恰好完全反应,产生两种无毒又不污染环境的气态物质,应生成氮气与水,8gN2H4的物质的量为$\frac{8g}{32g/mol}$=0.25mol,1molN2H4反应放出的热量为375kJ×$\frac{1mol}{0.25mol}$=1500kJ,反应热化学方程式为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-1500 kJ/mol,
故答案为: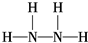 ;N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-1500 kJ/mol.
;N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-1500 kJ/mol.
点评 本题考查原子结构与性质关系、离子半径半径、铝热反应、盐类水解、化学键等,难度不大,旨在考查学生对基础知识的理解掌握.

Ⅰ锂的原子结构示意图为
 ;锂暴露在湿空气中时,会迅速地失去金属光泽、表面开始变黑,更长时间则变成白色.生成的化合物是氮化锂、氢氧化锂,最终生成碳酸锂.写出生成氮化锂的化学方程式6Li+N2=2Li3N.
;锂暴露在湿空气中时,会迅速地失去金属光泽、表面开始变黑,更长时间则变成白色.生成的化合物是氮化锂、氢氧化锂,最终生成碳酸锂.写出生成氮化锂的化学方程式6Li+N2=2Li3N.Ⅱ下面是从锂辉石(Li2O•Al2O3•SiO2)中提出锂的工业流程示意图.
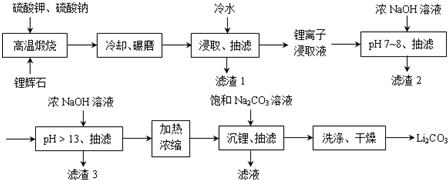
①高温煅烧时的反应原理为:
Li2O•Al2O3•SiO2+K2SO4=K2O•Al2O3•SiO2+Li2SO4
Li2O•Al2O3•SiO2+Na2SO4=Na2O•Al2O3•SiO2+Li2SO4
②锂离子浸取液中含有的金属离子为:K+、Na+、Li+、Fe3+、Fe2+、Al3+、Mn2+.
③几种金属离子沉淀完全的pH
| 金属离子 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 |
| 沉淀完全的pH | 4.7 | 9.0 | 3.2 | 10.1 |
| 温度 溶解度 | 10℃ | 20℃ | 50℃ | 80℃ |
| Li2SO4 | 35.4 | 34.7 | 33.1 | 31.7 |
| Li2CO3 | 1.43 | 1.33 | 1.08 | 0.85 |
(2)滤渣2的主要成分为Al(OH)3、Fe(OH)3.
(3)流程中分2次调节pH(pH7~8和pH>13),有研究者尝试只加一次浓NaOH溶液使pH>13,结果发现在加饱和碳酸钠溶液沉锂后,随着放置时间延长,白色沉淀增加,最后得到的Li2CO3产品中杂质增多.Li2CO3产品中的杂质可能是Al(OH)3,用离子方程式表示其产生的原因Al3++4OH-=AlO2-+2H2O;2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-.
(4)加热浓缩的作用是提高Li+ 浓度和溶液温度,使得Li2CO3容易析出.
(5)洗涤Li2CO3晶体使用热水.
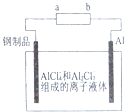 已知:银锌电池放电时总反应为Zn+Ag2O+H2O═Zn(OH)2+2Ag,用银锌电池作电源,在非水体系中完成钢制品上镀铝的原理如图所示,下列说法正确的是( )
已知:银锌电池放电时总反应为Zn+Ag2O+H2O═Zn(OH)2+2Ag,用银锌电池作电源,在非水体系中完成钢制品上镀铝的原理如图所示,下列说法正确的是( )| A. | a电极的电极反应式为Ag2O+H2O+2e-=2Ag+2OH- | |
| B. | 银锌电池的电解质溶液可用稀硫酸 | |
| C. | 银锌电池放电时,负极附近溶液的pH增大 | |
| D. | Al电极上发生的电极反应式为Al+7AlCl4--3e-=4Al2Cl4- |
| A. | 一定互为同位素 | B. | 一定是同种原子 | ||
| C. | 一定属于同种元素 | D. | 质量数一定相等 |
| A. | 第一主族的元素称为碱金属 | |
| B. | 第二周期元素的最高化合价依次递增,并等于它所处的主族序数 | |
| C. | 短周期元素形成离子后,最外层电子都达到8电子稳定结构 | |
| D. | 同一主族的元素的原子,最外层电子数一定相同 |
| 主族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 | |
| 2 | ① | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | |||||
(2)表中氧化性最强的单质的化学式为F2;
(3)这些元素的最高价氧化物的水化物中,碱性最强的是NaOH(填化学式);
(4)写出由⑤形成的单质Ne(填化学式符号);
(5)表中能形成两性氢氧化物的元素是Al(填元素符号).
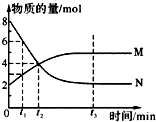 在一定温度下,容器内某一反应中气体M、N的物质的量随反应时间变化的曲线如图所示,下列表述中正确的是( )
在一定温度下,容器内某一反应中气体M、N的物质的量随反应时间变化的曲线如图所示,下列表述中正确的是( )| A. | 反应的化学方程式为:2M?N | B. | t2时,正逆反应速率相等 | ||
| C. | t3时,正反应速率大于逆反应速率 | D. | t1时,N的浓度是M浓度的2倍 |
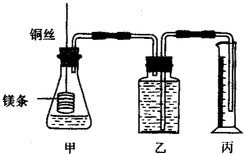 某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图,该实验的主要操作步骤如下:
某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图,该实验的主要操作步骤如下: