题目内容
5.锂元素被誉为“能源元素”.锂及锂盐具有的优异性能和特殊功能,在化工、电子、宇航、核能、能源等领域都得到广泛应用.Ⅰ锂的原子结构示意图为
 ;锂暴露在湿空气中时,会迅速地失去金属光泽、表面开始变黑,更长时间则变成白色.生成的化合物是氮化锂、氢氧化锂,最终生成碳酸锂.写出生成氮化锂的化学方程式6Li+N2=2Li3N.
;锂暴露在湿空气中时,会迅速地失去金属光泽、表面开始变黑,更长时间则变成白色.生成的化合物是氮化锂、氢氧化锂,最终生成碳酸锂.写出生成氮化锂的化学方程式6Li+N2=2Li3N.Ⅱ下面是从锂辉石(Li2O•Al2O3•SiO2)中提出锂的工业流程示意图.
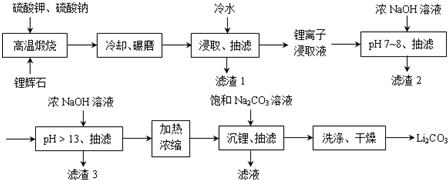
①高温煅烧时的反应原理为:
Li2O•Al2O3•SiO2+K2SO4=K2O•Al2O3•SiO2+Li2SO4
Li2O•Al2O3•SiO2+Na2SO4=Na2O•Al2O3•SiO2+Li2SO4
②锂离子浸取液中含有的金属离子为:K+、Na+、Li+、Fe3+、Fe2+、Al3+、Mn2+.
③几种金属离子沉淀完全的pH
| 金属离子 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 |
| 沉淀完全的pH | 4.7 | 9.0 | 3.2 | 10.1 |
| 温度 溶解度 | 10℃ | 20℃ | 50℃ | 80℃ |
| Li2SO4 | 35.4 | 34.7 | 33.1 | 31.7 |
| Li2CO3 | 1.43 | 1.33 | 1.08 | 0.85 |
(2)滤渣2的主要成分为Al(OH)3、Fe(OH)3.
(3)流程中分2次调节pH(pH7~8和pH>13),有研究者尝试只加一次浓NaOH溶液使pH>13,结果发现在加饱和碳酸钠溶液沉锂后,随着放置时间延长,白色沉淀增加,最后得到的Li2CO3产品中杂质增多.Li2CO3产品中的杂质可能是Al(OH)3,用离子方程式表示其产生的原因Al3++4OH-=AlO2-+2H2O;2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-.
(4)加热浓缩的作用是提高Li+ 浓度和溶液温度,使得Li2CO3容易析出.
(5)洗涤Li2CO3晶体使用热水.
分析 I.锂的原子核外有2个电子层,各层电子数为2、1;Li与氮气反应生成Li3N;
Ⅱ.锂辉石(Li2O•Al2O3•4SiO2)煅烧后,冷却、研磨,有利于冷水的浸取,抽滤,得到滤渣为硅酸盐,结合锂离子浸取液中含有的金属离子、离子沉淀完全pH,可知加热NaOH浓溶液,调节溶液pH=7~8,Al3+、Fe3+转化为Al(OH)3、Fe(OH)3,抽滤后再加入NaOH浓溶液,调节溶液pH>13,应是将Mn2+转化为沉淀,抽滤后,加热浓缩,加入饱和碳酸钠溶液,由于Li2CO3的溶解度远小于Li2SO4,会析出Li2CO3,由于Li2CO3的溶解度随温度升高而减小,用热水洗涤可减少Li2CO3的损失,得到最终产物碳酸锂.
(1)Li2SO4的溶解度随温度升高而减少;
(2)滤渣2为氢氧化铝、氢氧化铁;
(3)只加一次浓NaOH溶液使pH>13,会使溶液中Al3+转化为AlO2-,放置后,空气中二氧化碳与AlO2-、水反应生成Al(OH)3;
(4)Li2CO3的溶解度随温度升高而减小,加热浓缩,提高Li+ 浓度和溶液温度,利用析出Li2CO3;
(5)Li2CO3的溶解度随温度升高而减小,应用热水洗涤.
解答 解:I.锂的原子核外有2个电子层,各层电子数为2、1,原子结构示意图为: ,Li与氮气反应生成Li3N,反应方程式为:6Li+N2=2Li3N,
,Li与氮气反应生成Li3N,反应方程式为:6Li+N2=2Li3N,
故答案为: ;6Li+N2=2Li3N;
;6Li+N2=2Li3N;
Ⅱ.锂辉石(Li2O•Al2O3•4SiO2)煅烧后,冷却、研磨,有利于冷水的浸取,抽滤,得到滤渣为硅酸盐,结合锂离子浸取液中含有的金属离子、离子沉淀完全pH,可知加热NaOH浓溶液,调节溶液pH=7~8,Al3+、Fe3+转化为Al(OH)3、Fe(OH)3,抽滤后再加入NaOH浓溶液,调节溶液pH>13,应是将Mn2+转化为沉淀,抽滤后,加热浓缩,加入饱和碳酸钠溶液,由于Li2CO3的溶解度远小于Li2SO4,会析出Li2CO3,由于Li2CO3的溶解度随温度升高而减小,用热水洗涤可减少Li2CO3的损失,得到最终产物碳酸锂.
(1)Li2SO4的溶解度随温度升高而减少,用冷水浸取可以提高浸取率,故用冷水浸取,
故答案为:Li2SO4的溶解度随温度升高而减少,用冷水浸取可以提高浸取率;
(2)由上述分析可知,滤渣2为Al(OH)3、Fe(OH)3,
故答案为:Al(OH)3、Fe(OH)3;
(3)只加一次浓NaOH溶液使pH>13,会使溶液中Al3+转化为AlO2-,放置后,空气中二氧化碳与AlO2-、水反应生成Al(OH)3,Li2CO3产品中的杂质可能是Al(OH)3,相应的离子方程式为:Al3++4OH-=AlO2-+2H2O、2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-,
故答案为:Al(OH)3;Al3++4OH-=AlO2-+2H2O;2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-;
(4)Li2CO3的溶解度随温度升高而减小,加热浓缩,提高Li+ 浓度和溶液温度,使得Li2CO3容易析出,
故答案为:提高Li+ 浓度和溶液温度,使得Li2CO3容易析出;
(5)Li2CO3的溶解度随温度升高而减小,用热水洗涤可以减少碳酸锂的损耗,
故答案为:热水.
点评 本题考查物质制备实验方案、物质的分离提纯、对操作及条件控制的分析评价、对数据的分析运用等,是对学生综合能力的考查,难度中等.

| A. | H2 | B. | CO | C. | NH3 | D. | NaCl |
(1)将PM2.5样本用蒸馏水处理制成待测试样.测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH${\;}_{4}^{+}$ | SO${\;}_{4}^{2-}$ | NO3 | Cl- |
| 浓度/mol•L-l | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)NOx是汽车尾气的主要污染物之一.
①汽车发动机工作时会引发N2和O2反应,其能量变化示意图如图:

则N2(g)和O2(g)反应生成NO(g)的热化学反应方程式为N2(g)+O2(g)=2NO(g)△H=+184kJ•mol-1;
②用碱液吸收氮的氧化物是目前研究的课题,将NO、NO2通入石灰乳中可制备重要的工业原料Ca(NO2)2.该工艺需控制NO和NO2物质的量之比接近1:1.若n(NO2):n(NO)>1:1,则会导致产品Ca(NO2)2中Ca(NO3)2含量升高;若n(NO2):n(NO)<1:1,则会导致排放气体中NO含量升高.
(3)燃煤烟气中的CO、SO2在铝矾土作催化剂、773K条件下反应生成CO2和硫蒸气,该反应可用于从烟道气中回收硫.反应体系中各组分的物质的量与反应时间的关系如图2所示,写出该反应的化学方程式4CO+2SO2=4CO2+S2.
(4)科学家用氮化镓材料与铜组装如图3所示的人工光合系统.利用该装置成功地实现了以CO2和H2O合成CH4.写出铜电极表面的电极反应式CO2+8e-+8H+=CH4+2H2O.
(5)天然气也可重整生产化工原料.最近科学家们利用天然气无氧催化重整获得芳香烃X.由质谱分析得X的相对分子质量为106,其核磁共振氢谱如图4,则X的结构简式为
 .
. 
已知:
| 物质 | SiCl4 | AlCl3 | FeCl3 | FeCl2 | NaCl |
| 沸点/℃ | 57.6 | 180(升华) | 300(升华) | 1023 | 801 |
(1)高温反应前,常在800℃焙烧铝土矿,使固体中水分挥发、气孔数目增多,其作用是防止后续步骤生成的AlCl3水解或增大反应物的接触面积,加快反应速率(只要求写出一种)
(2)高温反应后,铝土矿中的氧化物均转变为相应的氯化物,由Al2O3、C和Cl2反应生成AlCl3的化学方程式为Al2O3+3C+3Cl2$\frac{\underline{\;高温\;}}{\;}$2AlCl3+3CO.
(3)气体Ⅱ的主要成分除了Cl2外,还含有CO2、O2、SiCl4.气体Ⅱ常用过量冷的NaOH溶液吸收,吸收液中含有的阴离子主要有CO32-、HCO3-、Cl-、ClO-、SiO32-、OH-.
(4)工业上为了降低生产成本,生产过程中需要控制加入铝粉的量,“废渣”的主要成分是NaCl、FeCl2.
(5)AlCl3和NaCl的熔融盐常用于镀铝电解池,电镀时AlCl4-和Al2Cl7-两种离子在电极上相互转化,其它离子不参与电极反应,电镀时阴极的电极反应式为4Al2Cl7-+3e-=7AlCl4-+Al.
| A. | C17H19NO3 | B. | C17H21NO4 | C. | C17H25NO3 | D. | C25H27NO7 |
| 选项 | 说法 | 解释 |
| A | 加热条件下,浓硝酸与碳粉的反应可在铁制容器中进行 | 铁能被浓硝酸钝化 |
| B | 浓氨水可用于检验氯气管道泄露 | 过量的NH3与Cl2反应有白烟产生 |
| C | 用惰性电极电解MgCl2溶液可冶炼Mg | Mg2+在阴极得电子生成Mg |
| D | 葡萄糖和油脂均为人体所需能量的重要来源 | 二者在体内水解的产物被氧化可提供能量 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 氯化氢气体溶于水 | B. | 冰的融化 | ||
| C. | 食盐溶于水 | D. | 氢气和氯气生成氯化氢 |
 .
.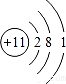 ,其中三种主族元素的离子半径从大到小的顺序是N3->O2->Na+ (用离子符号表示)
,其中三种主族元素的离子半径从大到小的顺序是N3->O2->Na+ (用离子符号表示)