题目内容
2.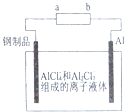 已知:银锌电池放电时总反应为Zn+Ag2O+H2O═Zn(OH)2+2Ag,用银锌电池作电源,在非水体系中完成钢制品上镀铝的原理如图所示,下列说法正确的是( )
已知:银锌电池放电时总反应为Zn+Ag2O+H2O═Zn(OH)2+2Ag,用银锌电池作电源,在非水体系中完成钢制品上镀铝的原理如图所示,下列说法正确的是( )| A. | a电极的电极反应式为Ag2O+H2O+2e-=2Ag+2OH- | |
| B. | 银锌电池的电解质溶液可用稀硫酸 | |
| C. | 银锌电池放电时,负极附近溶液的pH增大 | |
| D. | Al电极上发生的电极反应式为Al+7AlCl4--3e-=4Al2Cl4- |
分析 根据电池反应式Ag2O+Zn=2Ag+ZnO知,失电子的物质作负极,得电子的物质作正极,原电池放电时,阳离子移向正极,根据电池电极附近氢离子或氢氧根离子浓度的变化判断溶液pH值的变化,铝电极为阳极,失去电子发生氧化反应.
解答 解:A、电池反应式Ag2O+Zn=2Ag+ZnO中,a为负极,失去电子发生氧化反应,故A错误;
B、电池反应式Zn+Ag2O+H2O═Zn(OH)2+2Ag中,电解质若为硫酸,则不可能产生碱性物质,故B错误;
C、极反应为Zn+2OH--2e-=Zn(OH)2,工作时负极区溶液的pH减小,故C错误;
D、Al电极上发生的电极反应式为Al+7AlCl4--3e-=4Al2Cl4,故D正确.
故选D.
点评 本题考查了原电池原理,难度不大,明确原电池正负极的判断方法、电极附近离子浓度的变化导致溶液pH值的变化即可解答本题.

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目
18.下列选用的相关仪器符合实验要求的是( )
| A. |  存放浓硝酸 | B. |  分离水和乙酸乙酯 | ||
| C. |  准确量取9.50mL液体 | D. |  存放氯化钙固体 |
13.大气中PM2.5、NOx、SO2、CO2、CH4等含量是衡量空气质量优劣的重要指标,对其研究和综合治理具有重要意义.
(1)将PM2.5样本用蒸馏水处理制成待测试样.测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
根据表中数据计算PM2.5试样的pH=4.
(2)NOx是汽车尾气的主要污染物之一.
①汽车发动机工作时会引发N2和O2反应,其能量变化示意图如图:

则N2(g)和O2(g)反应生成NO(g)的热化学反应方程式为N2(g)+O2(g)=2NO(g)△H=+184kJ•mol-1;
②用碱液吸收氮的氧化物是目前研究的课题,将NO、NO2通入石灰乳中可制备重要的工业原料Ca(NO2)2.该工艺需控制NO和NO2物质的量之比接近1:1.若n(NO2):n(NO)>1:1,则会导致产品Ca(NO2)2中Ca(NO3)2含量升高;若n(NO2):n(NO)<1:1,则会导致排放气体中NO含量升高.
(3)燃煤烟气中的CO、SO2在铝矾土作催化剂、773K条件下反应生成CO2和硫蒸气,该反应可用于从烟道气中回收硫.反应体系中各组分的物质的量与反应时间的关系如图2所示,写出该反应的化学方程式4CO+2SO2=4CO2+S2.
(4)科学家用氮化镓材料与铜组装如图3所示的人工光合系统.利用该装置成功地实现了以CO2和H2O合成CH4.写出铜电极表面的电极反应式CO2+8e-+8H+=CH4+2H2O.
(5)天然气也可重整生产化工原料.最近科学家们利用天然气无氧催化重整获得芳香烃X.由质谱分析得X的相对分子质量为106,其核磁共振氢谱如图4,则X的结构简式为 .
.
(1)将PM2.5样本用蒸馏水处理制成待测试样.测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH${\;}_{4}^{+}$ | SO${\;}_{4}^{2-}$ | NO3 | Cl- |
| 浓度/mol•L-l | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)NOx是汽车尾气的主要污染物之一.
①汽车发动机工作时会引发N2和O2反应,其能量变化示意图如图:

则N2(g)和O2(g)反应生成NO(g)的热化学反应方程式为N2(g)+O2(g)=2NO(g)△H=+184kJ•mol-1;
②用碱液吸收氮的氧化物是目前研究的课题,将NO、NO2通入石灰乳中可制备重要的工业原料Ca(NO2)2.该工艺需控制NO和NO2物质的量之比接近1:1.若n(NO2):n(NO)>1:1,则会导致产品Ca(NO2)2中Ca(NO3)2含量升高;若n(NO2):n(NO)<1:1,则会导致排放气体中NO含量升高.
(3)燃煤烟气中的CO、SO2在铝矾土作催化剂、773K条件下反应生成CO2和硫蒸气,该反应可用于从烟道气中回收硫.反应体系中各组分的物质的量与反应时间的关系如图2所示,写出该反应的化学方程式4CO+2SO2=4CO2+S2.
(4)科学家用氮化镓材料与铜组装如图3所示的人工光合系统.利用该装置成功地实现了以CO2和H2O合成CH4.写出铜电极表面的电极反应式CO2+8e-+8H+=CH4+2H2O.
(5)天然气也可重整生产化工原料.最近科学家们利用天然气无氧催化重整获得芳香烃X.由质谱分析得X的相对分子质量为106,其核磁共振氢谱如图4,则X的结构简式为
 .
.
10.吸食毒品会造成死亡,青少年都要拒绝毒品,珍爱生命,吗啡和海洛因都是严格查禁的毒品,海洛因分子式为C21H23NO5.海洛因是吗啡的二乙酸酯,则吗啡的分子式是( )
| A. | C17H19NO3 | B. | C17H21NO4 | C. | C17H25NO3 | D. | C25H27NO7 |
17.化学与生产、生活密切相关,下来说法和解释均正确的是( )
| 选项 | 说法 | 解释 |
| A | 加热条件下,浓硝酸与碳粉的反应可在铁制容器中进行 | 铁能被浓硝酸钝化 |
| B | 浓氨水可用于检验氯气管道泄露 | 过量的NH3与Cl2反应有白烟产生 |
| C | 用惰性电极电解MgCl2溶液可冶炼Mg | Mg2+在阴极得电子生成Mg |
| D | 葡萄糖和油脂均为人体所需能量的重要来源 | 二者在体内水解的产物被氧化可提供能量 |
| A. | A | B. | B | C. | C | D. | D |
7.元素R的质量数为A,Rn-的核外电子数为x,则w g Rn-所含中子的物质的量为( )
| A. | (A-x+n) mol | B. | (A-x-n) mol | C. | (A-x+n)$\frac{w}{A}$ mol | D. | (A-x-n)$\frac{w}{A}$ mol |
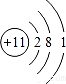 ,其中三种主族元素的离子半径从大到小的顺序是N3->O2->Na+ (用离子符号表示)
,其中三种主族元素的离子半径从大到小的顺序是N3->O2->Na+ (用离子符号表示)