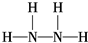题目内容
3.表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白.| 主族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 | |
| 2 | ① | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | |||||
(2)表中氧化性最强的单质的化学式为F2;
(3)这些元素的最高价氧化物的水化物中,碱性最强的是NaOH(填化学式);
(4)写出由⑤形成的单质Ne(填化学式符号);
(5)表中能形成两性氢氧化物的元素是Al(填元素符号).
分析 由元素在周期表中位置,可知①为C、②为N、③为O、④为F、⑤为Ne、⑥为Na、⑦为Al、⑧为S,⑨为Cl.
(1)同一周期的元素的原子从左到右,原子半径逐渐减小,而稀有气体的原子的半径最大,同主族自上而下半径逐渐增大;
(2)周期表中,从左到右氧化性逐渐增强,从下到上氧化性逐渐增强;
(3)周期表中,从左到右最高价氧化物的水化物碱性逐渐减弱,从下到上最高价氧化物的水化物碱性逐渐减弱;
(4)Ne形成的单质为Ne;
(5)氢氧化铝为两性氢氧化物.
解答 解:由元素在周期表中位置,可知①为C、②为N、③为O、④为F、⑤为Ne、⑥为Na、⑦为Al、⑧为S,⑨为Cl,
(1)根据同一周期的元素的原子从左到右,原子半径逐渐减小,而稀有气体的原子的半径最大,同主族自上而下半径逐渐增大,)①②⑥⑦中原子半径最小的是N,
故答案为:N;
(2)周期表中,氧化性最强的元素位于最右上角,所以氧化性最强的单质是F2,故答案为:F2;
(3)周期表中,从左到右最高价氧化物的水化物碱性逐渐减弱,从下到上最高价氧化物的水化物碱性逐渐减弱,所以NaOH的碱性最强,故答案为:NaOH;
(4)Ne形成单原子分子Ne,故答案为:Ne;
(5)Al的氢氧化物Al(OH)3和强酸强碱反应都生成盐和水,故答案为:Al.
点评 本题考查了元素周期表和元素周期律综合应用,根据元素周期表结构及元素位置推断元素,再结合物质性质分析解答,题目难度不大.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
13.大气中PM2.5、NOx、SO2、CO2、CH4等含量是衡量空气质量优劣的重要指标,对其研究和综合治理具有重要意义.
(1)将PM2.5样本用蒸馏水处理制成待测试样.测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
根据表中数据计算PM2.5试样的pH=4.
(2)NOx是汽车尾气的主要污染物之一.
①汽车发动机工作时会引发N2和O2反应,其能量变化示意图如图:

则N2(g)和O2(g)反应生成NO(g)的热化学反应方程式为N2(g)+O2(g)=2NO(g)△H=+184kJ•mol-1;
②用碱液吸收氮的氧化物是目前研究的课题,将NO、NO2通入石灰乳中可制备重要的工业原料Ca(NO2)2.该工艺需控制NO和NO2物质的量之比接近1:1.若n(NO2):n(NO)>1:1,则会导致产品Ca(NO2)2中Ca(NO3)2含量升高;若n(NO2):n(NO)<1:1,则会导致排放气体中NO含量升高.
(3)燃煤烟气中的CO、SO2在铝矾土作催化剂、773K条件下反应生成CO2和硫蒸气,该反应可用于从烟道气中回收硫.反应体系中各组分的物质的量与反应时间的关系如图2所示,写出该反应的化学方程式4CO+2SO2=4CO2+S2.
(4)科学家用氮化镓材料与铜组装如图3所示的人工光合系统.利用该装置成功地实现了以CO2和H2O合成CH4.写出铜电极表面的电极反应式CO2+8e-+8H+=CH4+2H2O.
(5)天然气也可重整生产化工原料.最近科学家们利用天然气无氧催化重整获得芳香烃X.由质谱分析得X的相对分子质量为106,其核磁共振氢谱如图4,则X的结构简式为 .
.
(1)将PM2.5样本用蒸馏水处理制成待测试样.测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH${\;}_{4}^{+}$ | SO${\;}_{4}^{2-}$ | NO3 | Cl- |
| 浓度/mol•L-l | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)NOx是汽车尾气的主要污染物之一.
①汽车发动机工作时会引发N2和O2反应,其能量变化示意图如图:

则N2(g)和O2(g)反应生成NO(g)的热化学反应方程式为N2(g)+O2(g)=2NO(g)△H=+184kJ•mol-1;
②用碱液吸收氮的氧化物是目前研究的课题,将NO、NO2通入石灰乳中可制备重要的工业原料Ca(NO2)2.该工艺需控制NO和NO2物质的量之比接近1:1.若n(NO2):n(NO)>1:1,则会导致产品Ca(NO2)2中Ca(NO3)2含量升高;若n(NO2):n(NO)<1:1,则会导致排放气体中NO含量升高.
(3)燃煤烟气中的CO、SO2在铝矾土作催化剂、773K条件下反应生成CO2和硫蒸气,该反应可用于从烟道气中回收硫.反应体系中各组分的物质的量与反应时间的关系如图2所示,写出该反应的化学方程式4CO+2SO2=4CO2+S2.
(4)科学家用氮化镓材料与铜组装如图3所示的人工光合系统.利用该装置成功地实现了以CO2和H2O合成CH4.写出铜电极表面的电极反应式CO2+8e-+8H+=CH4+2H2O.
(5)天然气也可重整生产化工原料.最近科学家们利用天然气无氧催化重整获得芳香烃X.由质谱分析得X的相对分子质量为106,其核磁共振氢谱如图4,则X的结构简式为
 .
.
18.“10%的氨水”的正确解释是( )
| A. | 100g氨水中含10gNH3•H2O | B. | 10gNH3溶于水形成100g溶液 | ||
| C. | 100g氨水中含10gNH3 | D. | 10gNH3溶于100gH2O形成的溶液 |
8.下列因素一定会使化学反应速率加快的是( )
①增加反应物的物质的量
②升高温度
③缩小容器的体积
④加入生成物.
①增加反应物的物质的量
②升高温度
③缩小容器的体积
④加入生成物.
| A. | ①②④ | B. | ②④ | C. | ①②③ | D. | 只有② |
15.下列变化过程中,没有化学键被破坏的是( )
| A. | 氯化氢气体溶于水 | B. | 冰的融化 | ||
| C. | 食盐溶于水 | D. | 氢气和氯气生成氯化氢 |
13.下列物质中能使酸性KMnO4溶液褪色的是( )
①乙烯 ②苯 ③乙醇 ④甲烷 ⑤乙酸 ⑥二氧化硫.
①乙烯 ②苯 ③乙醇 ④甲烷 ⑤乙酸 ⑥二氧化硫.
| A. | ①②③④⑤ | B. | ①③⑥ | C. | ②④⑤ | D. | ②④⑤⑥ |
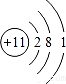 ,其中三种主族元素的离子半径从大到小的顺序是N3->O2->Na+ (用离子符号表示)
,其中三种主族元素的离子半径从大到小的顺序是N3->O2->Na+ (用离子符号表示)