题目内容
10.某化学学习小组用某种粗盐进行提纯实验,步骤如图所示:已知粗盐中含有的杂质离子主要为:Mg2+、Ca2+、Fe3+、SO42-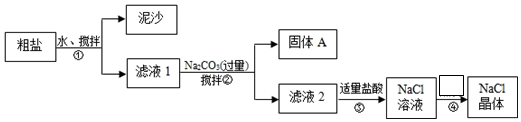
(1)步骤①和②的操作名称是过滤,所需要玻璃仪器为漏斗、烧杯、玻璃棒
(2)步骤②中在加入Na2CO3溶液之前还需加入过量NaOH溶液和BaCl2溶液固体A是:Mg(OH)2、CaCO3、Fe(OH)3、BaSO4、BaCO3.(用化学式表示)
(3)步骤②中检验SO42-沉淀完全的操作是:静置,向上层清液中加入少量BaCl2溶液,若无沉淀生成,则说明沉淀完全
(4)步骤③中加入盐酸的作用是(用离子方程式表示)H++OH-=H2O、CO32-+2H+=CO2↑+H2O
(5)步骤④的操作为:蒸发浓缩、过滤.
分析 (1)根据步骤①和②实现的物质的分离,来得出操作名称;根据操作需要,得出所需要的仪器.
(2)此题考查了加入试剂的作用以及发生的反应.根据加入过量NaOH溶液、BaCl2溶液、Na2CO3溶液的目的来分析本题.
(3)静置,向上层清液中加入少量BaCl2溶液,若无沉淀生成,则说明沉淀完全;
(4)根据分析步骤①和②后,溶液中仍有过量的NaOH和Na2CO3,来分析所加试剂;
(5)经过步骤③后得NaCl溶液,可以通过蒸发浓缩、过滤的方法,得到NaCl晶体.
解答 解:(1)从框图可知,步骤①和②均实现了固液分离,故操作均为过滤;过滤用到的玻璃仪器有漏斗、烧杯、玻璃棒.
故答案为:过滤;漏斗、烧杯、玻璃棒;
(2)粗盐提纯用到三种除杂试剂:NaOH溶液、BaCl2溶液和Na2CO3溶液.
加入过量NaOH溶液,能将Mg2+、Fe3+沉淀为Mg(OH)2、Fe(OH)3,发生反应:Mg2++2OH-=Mg(OH)2↓ Fe3++3OH-=Fe(OH)3↓,
加入过量的BaCl2溶液,能将SO42-沉淀为BaSO4,
加入Na2CO3溶液能将Ca2+、Ba2+沉淀为CaCO3、BaCO3.
故得到的沉淀有:Mg(OH)2、CaCO3、Fe(OH)3 、BaSO4 、BaCO3.
故答案为:Mg(OH)2、CaCO3、Fe(OH)3 、BaSO4 ;Mg2++2OH-=Mg(OH)2↓、Fe3++3OH-=Fe(OH)3↓;
(3)如果SO42-沉淀完全,则向上层清液中加入少量BaCl2溶液,应无沉淀生成,否则,则沉淀不完全,
故答案为:静置,向上层清液中加入少量BaCl2溶液,若无沉淀生成,则说明沉淀完全;
(4)经过步骤①和②后,溶液中有过量的NaOH和Na2CO3,可以通过加盐酸来除去:HCl+NaOH=H2O+NaCl、Na2CO3+2HCl=2NaCl+CO2↑+H2O,
离子方程式为:H++OH-=H2O、CO32-+2H+=CO2↑+H2O,
故答案为:H++OH-=H2O、CO32-+2H+=CO2↑+H2O;
(5)经过步骤③后得较纯净的NaCl溶液,通过蒸发浓缩、过滤,即可得到NaCl晶体.故答案为:蒸发浓缩.
点评 本题主要考查了粗盐的提纯所选用的试剂以及发生的反应,并考查了具体的实验操作问题,综合性较强,难度适中.

| A. | 在常温下,放热反应一般能自发进行,吸热反应都不能自发进行 | |
| B. | NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g)△H=+185.57kJ/mol,能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 | |
| C. | 氯化钴溶液中存在平衡: [Co(H2O)6]2+(粉红色)+4Cl-?[CoCl4]2-(蓝色)+6H2O;△H=akJ•mol-1,将氯化钴溶液置于冰水浴中,溶液变成粉红色,则可知:a<0 | |
| D. | 用容量瓶配制一定物质的量浓度的溶液,定容时俯视刻度线,所配溶液浓度偏小 |
| A. | 实验室配制的亚铁盐溶液在空气中被氧化:4Fe2++O2+2H2O═4Fe3++4OH- | |
| B. | 以金属银为阳极电解饱和硫酸铜溶液:Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+ | |
| C. | Ca(ClO)2溶液中通入过量的SO2气体:ClO-+SO2+H2O═HClO+HSO3- | |
| D. | 用酸化的高锰酸钾溶液氧化双氧水:2 MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O |
| A. | 植物油不能使溴水褪色 | |
| B. | 淀粉水解的最终产物是葡萄糖 | |
| C. | 葡萄糖能发生氧化反应和水解反应 | |
| D. | 蛋白质遇到硫酸铜后产生的沉淀能重新溶于水 |
| A. | 温度 | B. | 压强 | C. | 浓度 | D. | 催化剂 |
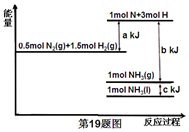
| A. | N2(g)+3H2(g)=2NH3(g)△H=-(b-a)kJ•mol-1 | |
| B. | N2(g)+3H2(g)=2NH3(g)△H=-(a-b)kJ•mol-1 | |
| C. | 2NH3(1)=N2(g)+3H2(g)△H=2(a+b-c)kJ•mol-1 | |
| D. | 2NH3(1)=N2(g)+3H2(g)△H=2(b+c-a)kJ•mol-1 |
| A. | 胶体属于介稳体系 | |
| B. | 蒸发操作中主要仪器是坩埚 | |
| C. | 粗盐经过溶解、过滤、蒸发后得到的是纯净的食盐 | |
| D. | NH4NO3不属于盐 |
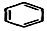 +H2C═CH2$\stackrel{一定条件}{→}$
+H2C═CH2$\stackrel{一定条件}{→}$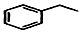
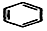 +2H2C═CH2$\stackrel{一定条件}{→}$
+2H2C═CH2$\stackrel{一定条件}{→}$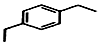
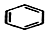 +2H2C═CH2$\stackrel{一定条件}{→}$
+2H2C═CH2$\stackrel{一定条件}{→}$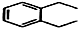
 .
.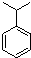 . N:
. N: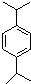 .
. 常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见图.下列叙述正确的是
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见图.下列叙述正确的是