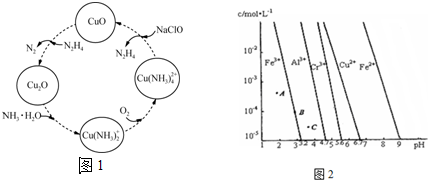
题目内容
2.相同条件下,体积相同的CO和CO2,物质的量比为1:1;其质量比为7:11;原子个数比为2:3;密度比为7:11.分析 依据阿伏伽德罗定律:相同条件下,气体体积相同,则气体物质的量相同,根据m=nM计算质量之比;
依据CO为双原子分子,CO2为三原子分子,计算原子个数比;
ρ=$\frac{M}{Vm}$计算两种气体密度之比.
解答 解:依据阿伏伽德罗定律:相同条件下,气体体积相同,则气体物质的量相同,所以二者物质的量之比:1:1;
依据m=nM,二者质量之比:1×28:1×44=7:11;
原子个数之比:1×2:1×3=2:3;
依据ρ=$\frac{M}{Vm}$可知密度之比与M成正比,所以相同条件下,体积相同的CO和CO2密度之比为:28:44=7:11;
故答案为:1:1,7:11,2:3,7:11.
点评 本题考查物质的量有关计算,熟悉以物质的量为核心计算公式,明确阿伏伽德罗定律是解题关键,题目难度不大.

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目
17.下面是一些学生的认识,其中正确的是( )
| A. | 在阴离子中,质子数一定少于核外电子数 | |
| B. | 氧化反应就是物质与氧气发生的反应 | |
| C. | 在化学反应中加入催化剂一定能加快反应的速率 | |
| D. | 最外层电子数为8的粒子一定是稀有气体元素的原子 |
7.某同学按如图所示的装置进行电解实验.下列说法正确的是( )
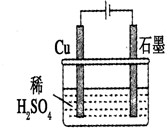

| A. | 石墨是电解池的负极,Cu是电解池的正极 | |
| B. | 电解过程中,铜电极上自身没什么变化 | |
| C. | 电解一定时间后,石墨电极上会有铜析出 | |
| D. | 整个电解过程中,溶液的pH不会变化 |
3.一包由Cu、Fe、Fe2O3三种物质构成的混合粉末,某合作学习小组的同学拟探究其组成.他们称取该混合粉末20.40g放入反应器中并连接气体收集装置,向反应器逐滴加入4.00mol•L-1硫酸溶液并缓慢搅拌.当加入硫酸a mL时,混合粉末恰好完全溶解,同时收集到bL(标准状况)H2,向反应后的溶液中滴入KSCN溶液,溶液不显红色.下列结论正确的是( )
| A. | 混合粉末中物质的量之间一定满足:n(Cu)+n(Fe)=n(Fe2O3) | |
| B. | 混合粉末中物质的量之间一定满足:n(Fe)>n(Cu)>n(Fe2O3) | |
| C. | 混合粉末中物质的量之间一定满足:n(Cu)+n(Fe)═n(Fe2O3)+$\frac{bL}{22.4L•mo{l}^{-1}}$ | |
| D. | 若a=72.50,b=1.12,则20.40g混合粉末中:n(Fe)=n(Cu)=0.05mol、n(Fe2O3)=0.09mol |
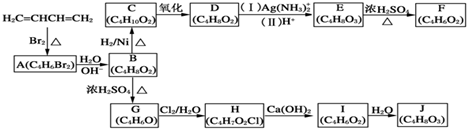
 +H2O,
+H2O,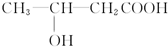 和
和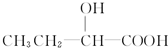 以外,还有
以外,还有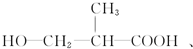 、
、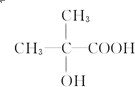 (写出结构简式,不考虑立体异构).
(写出结构简式,不考虑立体异构). ;
;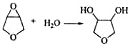 .
.
 ;
;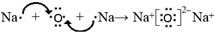 ;
;