题目内容
4.CO和联氨(N2H4)的性质及应用的研究是能源开发、环境保护的重要课题.(1)NH4Cl的水溶液显弱酸性,其原因为NH4++H2O?NH3•H2O+H+(用离子方程式表示);0.1mol•L-1的NH4Cl水溶液中加入少量明矾[KAl(SO4)2•12H2O],溶液中NH4+的浓度增大(填“增大”或“减小”).
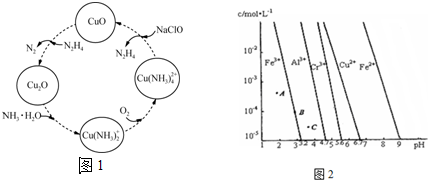
(2)联氨的性质类似于氨气,将联氨通入CuO浊液中,有关物质的转化如图1所示.
①在图示的转化中,化合价不变的元素是氢、钠(填元素名称).
②加入NaClO时发生的反应为:Cu(NH3)42++2ClO-+2OH-═Cu(OH)2↓+2N2H4↑+2Cl-+2H2O.该反应需在80℃以上进行,其目的除了加快反应速率外,还有使Cu(OH)2分解生成CuO、降低N2H4溶解度,促进N2H4的挥发.
(3)通过控制溶液的pH对工业废水中的金属离子进行分离.图2是常温时,某些金属氢氧化物在不同浓度和pH时的沉淀--溶解图象,图中直线上的点表示平衡状态.当溶液中的离子浓度小于1×10-5mol•L-1时,认为该离子沉淀完全.
①相同条件下,Fe(OH)3、Al(OH)3、Cr(OH)3三种物质的溶度积常数最大的是Cr(OH)3,图中A、B、C三点中表示Fe(OH)3的沉淀速率大于溶解速率的是C.
②由图可得Fe(OH)2的溶度积的值为1×10-15.
分析 (1)氯化铵溶液中,铵根离子部分水解生成一水合氨和氢离子,溶液显示酸性;加入明矾溶液后,铝离子水解抑制了铵根离子的水解,溶液中铵根离子的浓度增大;
(2)①该反应中H、Na元素都是在化合物,化合价不变;
②温度高时氢氧化铜分解,且气体溶解度随温度升高而降低;
(3)①由图象可知,相同条件下,Fe(OH)3、Al(OH)3、Cr(OH)3三种物质的溶度积常数最大的是Cr(OH)3;曲线上的点为饱和溶液时,曲线左边是未饱和溶液,右边为过饱和溶液;
②当PH=9时,c(Fe2+)=1×10-5mol•L-1,再根据Ksp表达式求算.
解答 解:(1)氯化铵溶液中,铵根离子发生水解:NH4++H2O?NH3•H2O+H+,溶液呈酸性;
明矾电离出的铝离子发生水解Al3++3H2O?Al(OH)3+3H+,则加入明矾后溶液中氢离子浓度增大,抑制了铵根离子的水解,导致溶液中铵根离子浓度增大,
故答案为:NH4++H2O?NH3•H2O+H+;增大;
(2)①根据图知,H、Na元素都在化合物中,化合价不变,故答案为:氢、钠;
②温度高时氢氧化铜分解,且气体溶解度随温度升高而降低,从而促进反应向正反应方向进行,
故答案为:使Cu(OH)2分解生成CuO;降低N2H4溶解度,促进N2H4的挥发;
(3)①图象分析判断,相同条件下,Fe(OH)3、Al(OH)3、Cr(OH)3三种物质的溶度积常数最大的是Cr(OH)3;曲线上的点为饱和溶液时,曲线左边是未饱和溶液,右边为过饱和溶液;在过饱和溶液中要有固体析出,C点为过饱和溶液,其溶质的沉淀速率大于溶解速率,
故答案为:Cr(OH)3;C;
②由图象可知,当PH=9时,c(Fe2+)=1×10-5mol•L-1,Ksp=c(Fe2+)•c2(OH-)=1×10-5×(1×10-5)2 =1×10-15,故答案为:1×10-15.
点评 本题考查较为综合,为高考常见题型,侧重于学生的分析能力、计算能力的考查,题目涉及氧化还原反应、化学方程式计算等知识点,明确元素化合价是解本题关键,注意该反应中元素化合价发生变化,图象分析判断方法的应用是解题关键,题目难度大.

 口算能手系列答案
口算能手系列答案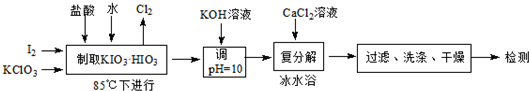
(1)若称取的I2质量为3.810g,为使I2充分氧化,则投料时KClO3的质量至少为3.675;同时生成的氯气体积为336mL(标准状况).
(2)用KOH溶液调节pH的目的是将KIO3•HIO3转变为KIO3.
(3)已知几种盐的溶解度(g/100g水)如下:
| 温度/℃ | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
| KCl | 28.1 | 31.2 | 34.2 | 40.1 | 45.8 | 51.3 |
| Ca(IO3)2 | 0.119 | 0.195 | 0.3071 | 0.520 | 0.621 | 0.669 |
| 碘酸钙存在形态 | 无水盐 | 一水合物 | 六水合物 |
| 稳定时的温度区域 | >57.5℃ | 32-57.5℃ | <32℃ |
(4)准确称取产品0.6000g于烧标中,加1:1高氯酸20mL,微热溶解后,冷却,配成250.00mL溶液.移取上述溶液50.00mL置于250mL碘量瓶中,加入1:1高氯酸2mL、3gKI(足量)(发生:IO3-+5I-+6H+═3I2+3H2O),盖上瓶盖,暗处放置3min,加50mL水,加入0.3%淀粉溶液2mL,用0.1000mol•L-1Na2S2O3溶液滴定(发生:I2+2S2O32-═2I-+S4O62-)到终点时消耗12.00mL,试计算产品中Ca(IO3)2的质量分数(给出计算过程).
| A. | 由此可确定碘元素的相对原子质量为131 | |
| B. | $\stackrel{131}{53}$I是碘元素的一种同位素 | |
| C. | $\stackrel{131}{53}$I核素中含中子数为53 | |
| D. | $\stackrel{131}{53}$I2的摩尔质量为262 g |
| A. | Cu | B. | Si | C. | SiO2 | D. | Al2O3 |
| A. | NaCl和Na2S | B. | HCl和NH3 | C. | AlCl3和H2O | D. | CH4和Na2O |