题目内容
7.下列贮存化学试剂的方法正确的是( )| A. | 新制的氯水保存在棕色广口瓶中,并放在阴凉处 | |
| B. | 波尔多液(CuSO4与石灰水按一定比例混合)盛放在铁制容器中 | |
| C. | 烧碱溶液放在带玻璃塞的磨口试剂瓶中 | |
| D. | 金属钠保存在煤油中 |
分析 A.液体放在细口瓶中,见光易分解的放在棕色瓶中;
B.铜离子和Fe发生置换反应;
C.烧碱能和玻璃的成分之一二氧化硅反应生成硅酸钠,是一种粘合剂;
D.金属钠属于活泼金属,易与水、氧气反应,需隔绝空气,煤油密度小于钠,且与钠不反应.
解答 解:A.氯水见光时其中的次氯酸会分解生成盐酸和氧气,并且属于液体,所以盛放在棕色细口瓶中,故A错误;
B.波尔多液中CuSO4能与Fe发生置换反应,不能盛放在铁制容器中,应该盛放在陶瓷容器中,故B错误;
C.烧碱能和玻璃中的二氧化硅反应生成硅酸钠,是一种粘合剂,会使瓶塞打不开,故应盛放在带有橡胶塞的试剂瓶中,故C错误;
D.金属钠易与空气中氧气反应、易与水反应,与煤油不反应且密度比煤油小,保存在煤油中可隔绝空气,防止钠变质,故D正确;
故选D.
点评 本题考查了试剂的存放和药品的保存,题目难度不大,属于实验基础题型,应注意易挥发药品要密封保存,易分解物质和避光、低温保存,具体物质要具体分析.

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案
相关题目
7.某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”.
(1)已知:KMnO4+H2C2O4+H2SO4→MnSO4+K2SO4+CO2↑+H20(未配平),向酸性KMnO4溶液中加入一定量的H2C2O4溶液,当溶液中的KMnO4耗尽后,紫色溶液将褪去.为确保能观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4):n(KMnO4)≥2.5.
(2)为探究反应物浓度对化学反应速率的影响,该小组设计了如下实验方案
表中x=2.0ml,理由是保证其它条件不变,只改变反应物H2C2O4浓度,从而达到对照实验的目的.
(1)已知:KMnO4+H2C2O4+H2SO4→MnSO4+K2SO4+CO2↑+H20(未配平),向酸性KMnO4溶液中加入一定量的H2C2O4溶液,当溶液中的KMnO4耗尽后,紫色溶液将褪去.为确保能观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4):n(KMnO4)≥2.5.
(2)为探究反应物浓度对化学反应速率的影响,该小组设计了如下实验方案
| 实验序号 | 反应温度/℃ | H2C2O4溶液 | 酸性KMnO4溶液 | H2O | ||
| V/mL | c(mol•L-1) | V/mL | c(mol•L-1) | V/mL | ||
| ① | 25 | 8.0 | 0.20 | 5.0 | 0.010 | 0 |
| ② | 25 | 6.0 | 0.20 | 5.0 | 0.010 | x |
8.从海水中提取溴有如下反应:5NaBr+NaBrO3+3H2SO4═3Br2+Na2SO4+3H2O,与上述反应在氧化还原反应原理上最相似的是( )
| A. | 3Cl2+6NaOH=2NaClO3+5NaCl+3H2O | |
| B. | CaH2+2H2O=Ca(OH)2+2H2↑ | |
| C. | AlCl3+3NaAlO2+6H2O=4Al(OH)3↓+3NaCl | |
| D. | 2CuO+Cu2S=4Cu+SO2↑ |
15.现有部分短周期元素的性质或原子结构如表且原子序数按XYTZ依次增大:
(1)四种元素原子半径由大到小的顺序是(写元素符号)S>Cl>C>N.
(2)元素Y与氢元素形成的一种离子YH4+,写出该微粒的电子式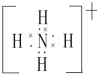 (用元素符号表示).
(用元素符号表示).
(3)T元素的简单阴离子的结构示意图是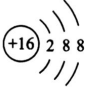 ,
,
(4)证明该粒子的还原性比Z-强的离子方程式是Cl2+S2-=S+2Cl-.
(5)元素Z的单质与氢氧化钠溶液反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O.
(6)将9g单质X在足量氧气中燃烧,所得气体通入1L 1mol•L-1NaOH溶液中,完全吸收后,将溶液在减压低温条件下蒸干,得到不含结晶水的固体质量为68.5g.
| 元素编号 | 元素性质或原子结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| T | 最外层电子数是电子层数的2倍 |
| Z | 元素最高正价是+7价 |
(2)元素Y与氢元素形成的一种离子YH4+,写出该微粒的电子式
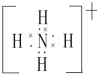 (用元素符号表示).
(用元素符号表示).(3)T元素的简单阴离子的结构示意图是
 ,
,(4)证明该粒子的还原性比Z-强的离子方程式是Cl2+S2-=S+2Cl-.
(5)元素Z的单质与氢氧化钠溶液反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O.
(6)将9g单质X在足量氧气中燃烧,所得气体通入1L 1mol•L-1NaOH溶液中,完全吸收后,将溶液在减压低温条件下蒸干,得到不含结晶水的固体质量为68.5g.
2.在H2O、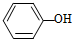
 、CH 3COOH、HCl的排列中,
、CH 3COOH、HCl的排列中, 应填入的物质是( )
应填入的物质是( )

 、CH 3COOH、HCl的排列中,
、CH 3COOH、HCl的排列中, 应填入的物质是( )
应填入的物质是( )| A. | H2SO4 | B. | CH3CH2OH | C. | H2CO3 | D. | CH3COOCH3 |
12.下列说法正确的是( )
| A. | 0.1mol•L-1硫化钠溶液中离子浓度关系:c(Na+)=2[c(S2-)+c(HS-)+c(H2S)] | |
| B. | 常温下醋酸分子不可能存在于pH>7的碱性溶液中 | |
| C. | 常温下向氯化铵溶液中加入少量氨水使溶液的pH=7,则混合溶液中:c(Cl-)>c(NH4+) | |
| D. | 0.1mol•L-1的氯化铵溶液与0.05mol•L-1的氢氧化钠溶液等体积混合后,混合溶液中离子浓度:c(Cl-)>c(NH4+)>c(Na+)>c(H+)>c(OH-) |
19.将淀粉加入试管里,加适量的水,振荡,加热煮沸,取所得溶液3mL,加1mL 稀硫酸溶液,加热一分钟,冷却后加入新制的Cu(OH)2悬浊液,加热后未见红色沉淀,其原因是( )
| A. | 加入Cu(OH)2浊液之前,未用NaOH溶液中和硫酸 | |
| B. | 制Cu(OH)2时,硫酸铜溶液太稀,NaOH过量了 | |
| C. | 加热时间不充分,淀粉没有充分水解 | |
| D. | 所用淀粉浓度不够 |
16.除去如表物质中所含少量杂质(括号内为杂质),所选用的试剂和分离方法能达到实验目的是( )
| 混合物 | 试剂 | 分离方法 | |
| A | CO2(HCl) | 饱和Na2CO3溶液 | 洗气 |
| B | 乙烷(乙烯) | 氢气 | 加热 |
| C | 溴(水) | 乙醇 | 蒸馏 |
| D | 乙醇(水) | 新制生石灰 | 蒸馏 |
| A. | A | B. | B | C. | C | D. | D |