题目内容
19.0.5mol NH3分子中所含氮原子数为0.5NA个.分析 结合N=nNA及分子构成计算.
解答 解:0.5mol NH3分子中所含氮原子数为0.5mol×NA=0.5NA个,
故答案为:0.5NA.
点评 本题考查物质的量的计算,为高频考点,把握微粒数与物质的量的关系为解答的关键,侧重分析与计算能力的考查,注意分子的构成,题目难度不大.

练习册系列答案
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案
相关题目
5.在30mL18mol/LH2SO4溶液中加入12g碳,加热,充分反应后被还原的H2SO4的物质的量为( )
| A. | 等于0.54mol | B. | 小于0.54mol | C. | 等于1.00mol | D. | 大于1.00mol |
7.下列叙述正确的是( )
| A. | 1 L水中溶解了40 g NaOH后,所得溶液浓度为1 mol/L | |
| B. | 从1 L 2 mol/L的NaCl溶液中取出0.5 L,该溶液的浓度为1 mol/L | |
| C. | 将2.24 L(标准状况)HCl气体溶于水制成100 mL溶液,其物质的量浓度为1 mol/L | |
| D. | 配制1 L 0.2 mol/L的CuSO4溶液,需用25 g胆矾 |
14.短周期元素a、b、c、d原子序数依次增大,a的核外电子总数与其周期数相同,b的某种单质是空气的主要成分,c的最外层电子数为其内层电子数的3倍,d与c同族:下列说法错误的是( )
| A. | a、b、d均可以与c形成两种或多种二元化合物 | |
| B. | d的原子半径是这些元素中最大的 | |
| C. | a与d形成的化合物可以抑制水的电离 | |
| D. | 常温下,由这四种元素构成的某种盐的溶液pH=4,则水电离出的H+浓度肯定是1×10-4mol/L |
4.下列实验操作或装置能达到实验目的是( )
| A. |  量取109.3mL稀盐酸 | B. |  称量25g烧碱固体 | ||
| C. |  碳酸氢钠受热分解 | D. | 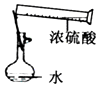 配制一定物质的量浓度的稀硫酸 |
11.下列说法不正确的是( )
| A. | 乙酸和甲醛分别完全燃烧,若消耗的氧气量一样,则它们的质量相等 | |
| B. | 铜丝表面的黑色氧化膜可用酒精除去 | |
| C. | Na2CO3溶液可使苯酚浊液变澄清 | |
| D. | 含0.01mol甲醛的福尔马林溶液与足量的银氨溶液充分反应,生成2.16gAg |
8.亚硝酸钠(NaNO2)俗称“工业盐”,其外观与食盐相似,有咸味,有毒,可用做食品防腐剂和肉类食品的发色剂.已知亚硝酸钠能与氢碘酸(HI,具有强酸性)发生如下反应:4HI+2NaNO2═2NaI+I2+2NO↑+2H2O.下列说法正确的是( )
| A. | 亚硝酸钠具有氧化性,不可能表现出还原性 | |
| B. | 该反应中氧化剂与还原剂的物质的量之比为1:1 | |
| C. | 向反应所得的混合溶液中加入稀硫酸和亚硝酸钠,I-不可能转化为I2 | |
| D. | 人误食亚硝酸钠中毒时,可服用氢碘酸解毒 |
9.设NA为阿伏加德罗常数的值,下列说法错误的是( )
| A. | 等质量的H2O与CH2D2含有的质子数相同 | |
| B. | 1L 0.1mol•L-1 NH4Cl溶液中Cl-的数目为0.1NA | |
| C. | 标准状况下,6.72L NO2与水充分反应转移的电子数为0.2NA | |
| D. | 1mol CH3COOC2H5在足量H2SO4溶液中水解得到的乙醇分子数为NA |