题目内容
4.下列说法正确的是( )| A. | 在化学反应中,反应物转化为生成物的同时,必然发生能量的变化 | |
| B. | 放热反应中,反应物的总能量大于生成物的总能量 | |
| C. | 放热反应发生时不一定要加热,但吸热反应必须要加热才能发生 | |
| D. | 断开化学键的过程会放出能量 |
分析 A.反应物化学键断裂吸收能量,生成物形成化学键放出能量;
B.反应物的总能量大于生成物的总能量,即反应后物质的能量降低;
C.吸热反应不一定需要加热;
D.断裂化学键吸收能量,形成化学键放出能量;
解答 解:A.反应物化学键断裂吸收能量,生成物形成化学键放出能量,化学反应过程中反应物转化为生成物的同时一定伴随能量变化,故A正确;
B,反应物的总能量大于生成物的总能量,即反应后物质的能量降低,则反应过程释放能量,即为放热反应,故B正确;
C.吸热反应不一定需要加热,如碳酸氢铵分解,在常温下就能发生,故C错误;
D.断裂化学键吸收能量,形成化学键放出能量,故D错误;
故选AB.
点评 本题考查了反应热与焓变,注意常见的吸热以及放热反应是解题的关键,注意把握反应的热效应与反应条件的关系,难度不大.

练习册系列答案
相关题目
14.某同学用某种粗盐进行提纯实验,步骤见下图.
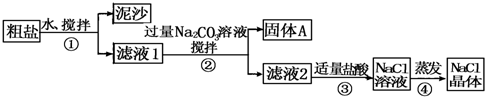
请回答:
(1)步骤①和②的操作名称是过滤.
(2)步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了防止液体溅出,当蒸发皿中有较多量固体出现时,应停止加热,用余热使水分蒸干.
(3)猜想和验证:

请回答:
(1)步骤①和②的操作名称是过滤.
(2)步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了防止液体溅出,当蒸发皿中有较多量固体出现时,应停止加热,用余热使水分蒸干.
(3)猜想和验证:
| 猜想 | 验证的方法 | 现象 | 结论 |
| 猜想Ⅰ:固体A中含CaCO3、MgCO3 | 取少量固体A于试管中,滴加稀盐酸,并用涂有澄清石灰水的小烧杯罩于试管口 | 有气泡冒出且烧杯中产生白色沉淀 | 猜想Ⅰ成立 |
| 猜想Ⅱ:固体A中含BaCO3 | 取少量固体A于试管中,先滴入稀盐酸或稀硝酸,再滴入Na2SO4溶液 | 有气泡放出,无白色沉淀 | 猜想II不成立 |
| 猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4 | 取少量NaCl晶体溶于试管中的蒸馏水,加入硝酸酸化的硝酸钡溶液 | 产生不溶于稀硝酸的白色沉淀 | 猜想Ⅲ成立 |
15.在一定温度下,向一个容积固定的密闭真空容器中充入2molX气体,发生反应X(g)?Y(g)+Z(g),使反应达到平衡,这时容器中的混合气体中X气体的体积分数是a%.若在同一容器中,最初放入的是1molY和1molZ的混合气体,并在相同的温度下使反应达到平衡,这时混合气体中X 气体所占的体积分欲是b%.则a和b的关系是( )
| A. | a>b | B. | a=b | C. | a<b | D. | 2a=b |
19.某温度下,体积一定的密闭容器中进行如下可逆反应X(g)+Y(g)?Z(g)+W(s)△H>0.下列叙述中,正确的是( )
| A. | 加入少量W,逆反应速率增大 | |
| B. | 当容器中气体压强不变时,反应达到平衡 | |
| C. | 升高温度,平衡逆向移动 | |
| D. | 改变条件,又达新平衡,此时上述反应的平衡常数K值一定增大 |
9.在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是( )
| A. | 甲的摩尔体积比乙的摩尔体积小 | |
| B. | 甲的物质的量比乙的物质的量多 | |
| C. | 甲的相对分子质量比乙的相对分子质量小 | |
| D. | 甲的分子数比乙的分子数少 |
16.下列过程中△H小于零的是( )
| A. | 氯酸钾分解制氧气 | B. | 氯化铵分解得氨气 | ||
| C. | 碳酸钙分解得二氧化碳 | D. | 实验室制备氢气 |
13.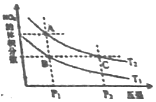 反应N2O4(g)?2NO2(g)△H>0,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是( )
反应N2O4(g)?2NO2(g)△H>0,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是( )
 反应N2O4(g)?2NO2(g)△H>0,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是( )
反应N2O4(g)?2NO2(g)△H>0,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是( )| A. | A、C两点的反应速率:A>C | |
| B. | A、C两点的化学平衡常数:A>C | |
| C. | A、C两点N2O4的转化率:A>C | |
| D. | 由状态B到状态A,可以用加热的方法 |
14.常温下,下列盐溶液 pH<7的是( )
| A. | NaHCO3溶液 | B. | NaHSO3溶液 | C. | CH3COONa溶液 | D. | Na2HPO4溶液 |
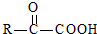 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$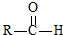 +H2O
+H2O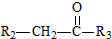 $→_{△}^{NaOH(aq)}$
$→_{△}^{NaOH(aq)}$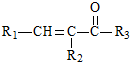 +H2O
+H2O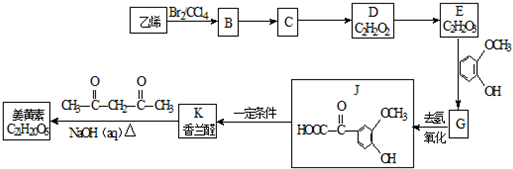
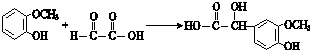 .
.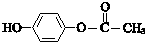
 .
.