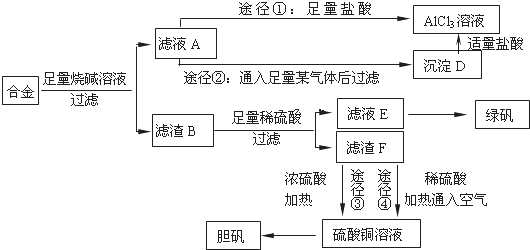
题目内容
19.某温度下,体积一定的密闭容器中进行如下可逆反应X(g)+Y(g)?Z(g)+W(s)△H>0.下列叙述中,正确的是( )| A. | 加入少量W,逆反应速率增大 | |
| B. | 当容器中气体压强不变时,反应达到平衡 | |
| C. | 升高温度,平衡逆向移动 | |
| D. | 改变条件,又达新平衡,此时上述反应的平衡常数K值一定增大 |
分析 A.W为固体,增大W的用量,不影响平衡的移动;
B.该反应正反应是气体体积减小的反应,随反应进行,压强降低,当压强不再变化,说明到达平衡状态;
C.升高温度平衡向吸热反应移动;
D.若改变压强或浓度,平衡常数不变,若降低温度,平衡常数减小.
解答 解:A.W在反应中是固体,固体量的增减不会引起化学反应速率的改变和化学平衡的移动,故A错误;
B.随反应进行,气体的物质的量减小,压强减小,压强不变说明到达平衡,说明该反应到达平衡状态,故B正确;
C.该反应正反应为吸热反应,升高温度平衡向吸热反应移动,即向正反应移动,故C错误;
D.平衡常数只与温度有关,若减小温度,平衡侧重逆向移动,平衡常数会减小;若改变的是浓度或压强,平衡常数不变,故D错误;
故选B.
点评 本题考查了化学平衡的影响因素,题目难度中等,注意掌握浓度、压强、温度等影响对化学平衡的影响,D为易错点,注意化学平衡常数只与温度的影响,试题有利于提高学生的分析、理解能力及灵活应用基础知识的能力.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
4.下列说法正确的是( )
| A. | 在化学反应中,反应物转化为生成物的同时,必然发生能量的变化 | |
| B. | 放热反应中,反应物的总能量大于生成物的总能量 | |
| C. | 放热反应发生时不一定要加热,但吸热反应必须要加热才能发生 | |
| D. | 断开化学键的过程会放出能量 |
8.对发现元素周期律贡献最大的化学家是( )
| A. | 阿佛加德罗 | B. | 道尔顿 | C. | 牛顿 | D. | 门捷列夫 |
9.在下列给定条件的溶液中,一定能大量共存的离子组是( )
| A. | 无色溶液:Ca2+、H+、Cl-、HSO3- | |
| B. | 能使pH试纸呈红色的溶液:Na+、NO3-、I-、AlO2- | |
| C. | FeCl3溶液:K+、Na+、Fe2+、S2- | |
| D. | $\frac{{K}_{W}}{c({H}^{+})}$=0.1mol/L的溶液:Na+、K+、SiO32-、NO3- |
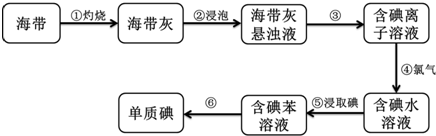



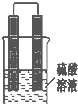 甲同学想利用原电池反应检测金属的活动性顺序,他使用镁片与铝片作电极,放入 稀H2SO4溶液中,如图所示•
甲同学想利用原电池反应检测金属的活动性顺序,他使用镁片与铝片作电极,放入 稀H2SO4溶液中,如图所示•