题目内容
11.6.1gSiO2跟足量的NaOH溶液反应,然后再用适量盐酸滴加至中性,生成的硅酸沉淀质量为7.8g.求此SiO2的纯度.分析 SiO2与NaOH溶液反应生成Na2SiO3,加入盐酸生成H2SiO3,关系式为SiO2~Na2SiO3~H2SiO3,结合关系式计算该题.
解答 解:反应关系式为SiO2~Na2SiO3~H2SiO3,设6.1gSiO2含有xg6.1gSiO2,则
SiO2~Na2SiO3~H2SiO3,
60g 78g
xg 7.8g
x=6,
则质量分数为$\frac{6}{6.1}×100%$=98.4%,
答:SiO2的纯度为98.4%.
点评 本题考查化学反应的计算,为高频考点,明确发生反应的原理为解答关键,注意掌握守恒在化学计算中的应用,试题培养了学生的分析能力及化学计算能力,难度不大.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
6.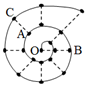 某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
 某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )| A. | 原子半径大小顺序:r(B)>r(C)>r(A) | |
| B. | B、C最高价氧化物的水化物可以相互反应 | |
| C. | 虚线相连的元素处于同一族,A、C元素都位于元素周期表ⅥA族 | |
| D. | A分别与B、C形成的化合物中化学键类型相同 |
16.O2F2可以发生反应:H2S+4O2F2=SF6+2HF+4O2,下列说法正确的是( )
| A. | 氧气是氧化产物 | |
| B. | 还原剂与氧化剂的物质的量之比为1:4 | |
| C. | 若生成4.48 L HF,则转移0.8 mol电子 | |
| D. | O2F2既是氧化剂又是还原剂 |
3.已知:草酸又名乙二酸,其一级电离常数Ka1=5.9×10-2,二级电离常数Ka2=6.4×10-5.常温下,向10mL 0.01mol•L-1 NaHC2O4溶液中滴加0.01mol•L-1 NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是( )
| A. | V(NaOH)=10时,c(OH-)+c(H2C2O4)═c(C2O42-)+c(H+) | |
| B. | V(NaOH)=100 mL时,可能存在c(Na+)>2c(C2O42-)+c(HC2O4-) | |
| C. | V(NaOH)=1000 mL时,c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4) | |
| D. | V(NaOH)=10 mL时,溶液中c(H+)=1×10-12 mol/L |
20.常温下,对于1L0.1mol/L的醋酸溶液,下列判断不正确的是( )
| A. | 该溶液的PH大于1 | |
| B. | c(OH-)=c(H+)-C(CH3COO-) | |
| C. | 与等体积、等浓度的NaOH溶液完全中和后,溶液显中性 | |
| D. | 与足量锌反应比等体积、等浓度的盐酸反应速率慢,生成氢气的质量相等 |

