题目内容
15.含FeS286%的黄铁矿燃烧时损失硫5%,由SO2转化为SO3时转化率为99%,则生产98%硫酸1吨,需黄铁矿的质量为( )| A. | 0.742吨 | B. | 0.85吨 | C. | 0.875吨 | D. | 1吨 |
分析 反应的关系式为FeS2 ~2H2SO4,根据硫酸的质量可确定FeS2的质量,以此解答该题.
解答 解:设需要含FeS286%的黄铁矿xt,则
FeS2 ~~~~~~~~2H2SO4
120 98×2
xt×86%×(1-5%)×99% 1t×98%
$\frac{120}{xt×86%×(1-5%)×99%}$=$\frac{98×2}{1t×98%}$,
x=0.742t.
故选A.
点评 本题考查化学方程式的计算,为高频考点,侧重考查学生的分析、计算能力,注意转化率的理解以及反应的转化关系,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.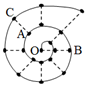 某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
 某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )| A. | 原子半径大小顺序:r(B)>r(C)>r(A) | |
| B. | B、C最高价氧化物的水化物可以相互反应 | |
| C. | 虚线相连的元素处于同一族,A、C元素都位于元素周期表ⅥA族 | |
| D. | A分别与B、C形成的化合物中化学键类型相同 |
3.已知:草酸又名乙二酸,其一级电离常数Ka1=5.9×10-2,二级电离常数Ka2=6.4×10-5.常温下,向10mL 0.01mol•L-1 NaHC2O4溶液中滴加0.01mol•L-1 NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是( )
| A. | V(NaOH)=10时,c(OH-)+c(H2C2O4)═c(C2O42-)+c(H+) | |
| B. | V(NaOH)=100 mL时,可能存在c(Na+)>2c(C2O42-)+c(HC2O4-) | |
| C. | V(NaOH)=1000 mL时,c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4) | |
| D. | V(NaOH)=10 mL时,溶液中c(H+)=1×10-12 mol/L |
20.常温下,对于1L0.1mol/L的醋酸溶液,下列判断不正确的是( )
| A. | 该溶液的PH大于1 | |
| B. | c(OH-)=c(H+)-C(CH3COO-) | |
| C. | 与等体积、等浓度的NaOH溶液完全中和后,溶液显中性 | |
| D. | 与足量锌反应比等体积、等浓度的盐酸反应速率慢,生成氢气的质量相等 |
7.反应Am(g+bN(g)?cP(g)+dQ(g)达到平衡时,M的体积分数y(M)与反应条件的关系如图.其中z表示反应开始时N的物质的量与M的物质的量之比.下列说法正确的是( )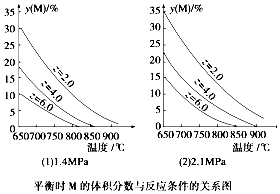

| A. | a+b<c+d | |
| B. | 同温同压时,增加z,平衡时Q的体积分数增加 | |
| C. | 同压同z时,升高温度,气体平均摩尔质量增加 | |
| D. | 同温同z时,增加压强,平衡时Q的物质的量浓度减小 |
4.下列能级中轨道数最多的是( )
| A. | f能级 | B. | d能级 | C. | s能级 | D. | p级 |
3.常温下,下列各组离子能在指定溶液中大量共存的是( )
| A. | 使甲基橙变红色的溶液中:Na+、Fe2+、MnO4-、AlO2- | |
| B. | $\frac{{K}_{w}}{c({H}^{+})}$=1×10-12mol/L,的溶液中:NH4+、Ca2+、Cl-、NO3- | |
| C. | PH=0的溶液中:Al3+、Ag(NH3)2+、I-、SO42- | |
| D. | 加入Mg能放出H2的溶液中:Ca2+、NH4+、ClO-、NO3- |
 CO(g)+H2(g)在一可变容积的密闭容器中进行,在其他条件不变的情况下,下列条件的改变对其反应速率几乎无影响的是
CO(g)+H2(g)在一可变容积的密闭容器中进行,在其他条件不变的情况下,下列条件的改变对其反应速率几乎无影响的是