题目内容
8.在标准状态下,1体积水溶解了700体积氨气,所得溶液的密度为0.9g/mL.求:(1)所得溶液的溶质的质量分数(用%表示,保留小数点后一位)
(2)所得溶液的物质的量浓度(保留小数点后一位)
分析 由标准状况下的体积可计算氨气的物质的量,利用氨气的质量和溶液的体积来计算物质的量浓度,而体积可由溶液的质量和密度来计算.
解答 解:NH3溶于水后虽然大部分生成NH3•H2O,但在计算时,仍以NH3作为氨水中的溶质;气体溶于水后,溶液的体积、密度均发生了改变,计算时应该用溶液质量除以密度求出其体积.设水的体积为1L,氨气的体积为700L,则氨气的物质的量为:$\frac{700L}{22.4L/mol}$=31.25mol,
溶液的质量为1000g+31.25mol×17g/mol=1531.25g,溶液的体积为:$\frac{1531.25g}{0.9g/L}$=1.7L,
(1)则氨水的质量分数为:$\frac{17g/mol×31.25mol}{1531.25g}$×100%=34.7%,
答:这种氨水的质量分数为34.7%;
(2)氨水的物质的量浓度为:c=$\frac{31.25mol}{1.7L}$=18.4 mol/L,
答:所得溶液的物质的量浓度为18.4 mol/L.
点评 本题考查学生物质的量浓度和质量分数的计算,题目难度不大,溶液的体积是学生解答本题的关键也是学生解答本题的易错点.

练习册系列答案
相关题目
18.下列说法不正确的是( )
| A. | 离子化合物一定含有离子键 | |
| B. | 共价化合物一定不含离子键 | |
| C. | 只含共价键的物质叫共价化合物 | |
| D. | 化学反应的过程,本质上是旧化学键断裂和新化学键形成的过程 |
19.对可逆反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g),下列叙述中正确的是( )
| A. | 达到化学平衡时,速率关系为:v(NH3):v(O2):v(NO):v(H2O)=4:5:4:6 | |
| B. | 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达平衡状态 | |
| C. | 达到化学平衡时,若增加体积,则正反应速率减小,逆反应速率增大 | |
| D. | 达到化学平衡时v正(O2):v逆(NO)=5:4 |
16.除去下列物质中的杂质,根据要求填空:
| 物质 | 杂质 | 选用试剂 | 化学方程式 |
| FeCl2溶液 | FeCl3 | 铁粉 | Fe+2FeCl3=3FeCl2 |
| SiO2 | Al 2O3 | 盐酸 | Al2O3+6HCl=2AlCl3+3H2O |
| Fe(OH)3 | Al(OH)3 | NaOH溶液 | Al(OH)3+NaOH=Na[Ai(OH)4] |
3.在下列反应中,浓硫酸既表现强氧化性,又表现酸性的是( )
| A. | NaCl+H2SO4(浓) | B. | Cu+H2SO4(浓) | C. | C+H2SO4(浓) | D. | CuO+H2SO4(浓) |
17.在第ⅦA族元素的卤化氢中,最容易分解成单质的是( )
| A. | HI | B. | HBr | C. | HCl | D. | HF |

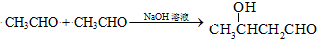 (甘氨酸)
(甘氨酸)
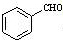 ;
; $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$ .
.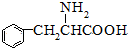 至少需要a步化学反应.
至少需要a步化学反应.