题目内容
13.某有机物4.6g 完全燃烧生成标准状况下二氧化碳2.24L 和1.8g 水,其蒸气的密度为2.054g/L (标准状况)求:(1)推测该有机物的分子式;
(2)又知该有机物能与乙醇发生酯化反应,试推测该有机物的分子结构,并写出与乙醇发生酯化的化学方程式.
分析 有机物蒸气的密度为2.054g/L,则相对分子质量为2.054×22.4=46,计算水、二氧化碳的物质的量可确定有机物分子式,该有机物能与乙醇发生酯化反应,说明含有羧基,以此解答该题.
解答 解:(1)有机物蒸气的密度为2.054g/L,则相对分子质量为2.054×22.4=46,n(CO2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,n(H2O)=$\frac{1.8g}{18g/mol}$=0.1mol,则有机物含有1个C原子、2H原子,O原子个数为=$\frac{46-12-2}{16}$=2,则分子式为CH2O2,
答:该有机物的分子式为CH2O2;
(2)该有机物能与乙醇发生酯化反应,应含有羧基,则有机物为HCOOH,与乙醇发生酯化反应的化学方程式为HCOOH+CH3CH2OH$→_{△}^{浓硫酸}$HCOOCH2CH3+H2O,
答:有机物为HCOOH,与乙醇发生酯化的化学方程式为HCOOH+CH3CH2OH$→_{△}^{浓硫酸}$HCOOCH2CH3+H2O.
点评 本题考查有机物的推断,为高频考点,注意掌握燃烧法利用原子守恒确定有机物分子式,侧重考查学生分析计算能力,难度不大.

练习册系列答案
相关题目
3.下列食品添加剂与其说明错误的是( )
| A. | 食醋--酸味剂 | B. | 苯甲酸--防腐剂 | ||
| C. | 碳酸氢钠--疏松剂 | D. | 亚硝酸钠--咸味剂 |
1.常温下的下列溶液,其中酸性最弱的是( )
| A. | pH=3的溶液 | B. | c(H+)=1×10-5mol/L的溶液 | ||
| C. | c(OH-)=1×10-12 mol/L的溶液 | D. | 0.005 mol/L的H2SO4溶液 |
2.据报道合成和分离了含高能量的N5+的化合物N5AsF6,下列叙述错误的是( )
| A. | N5+具有34个电子 | B. | N5+中氮-氮之间是以共价键结合 | ||
| C. | 化合物N5AsF6中As的化合价为+1 | D. | 化合物N5AsF6中F的化合价为-1 |

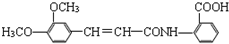 ).
).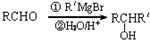
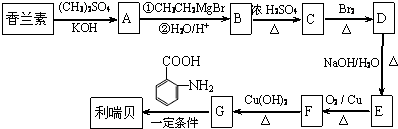
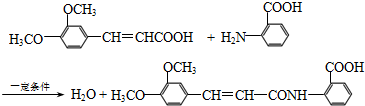
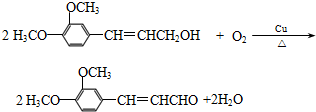
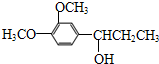 .
.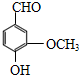 .
.

 图所涉及的物质均为中学化学中的常见物质,其中C为O2、D为C12、E为Fe单质,其余为化合物.它们存在如下转化关系,反应中生成的水及次要产物均已略去.
图所涉及的物质均为中学化学中的常见物质,其中C为O2、D为C12、E为Fe单质,其余为化合物.它们存在如下转化关系,反应中生成的水及次要产物均已略去.