题目内容
16.除去下列物质中的杂质,根据要求填空:| 物质 | 杂质 | 选用试剂 | 化学方程式 |
| FeCl2溶液 | FeCl3 | 铁粉 | Fe+2FeCl3=3FeCl2 |
| SiO2 | Al 2O3 | 盐酸 | Al2O3+6HCl=2AlCl3+3H2O |
| Fe(OH)3 | Al(OH)3 | NaOH溶液 | Al(OH)3+NaOH=Na[Ai(OH)4] |
分析 FeCl3可与Fe反应生成FeCl2;氧化铝可与盐酸反应;氢氧化铝为两性氢氧化物,可与氢氧化钠溶液反应而除去,以此解答该题.
解答 解:FeCl3可与Fe反应生成FeCl2,反应的方程式为Fe+2 FeCl3=3 FeCl2,氧化铝可与盐酸反应,反应的方程式为Al2O3+6HCl=2Al Cl3+3 H2O;氢氧化铝为两性氢氧化物,可与氢氧化钠溶液反应而除去,反应的方程式为Al (OH)3+NaOH=Na[Ai(OH)4],
| 物质 | 杂质 | 选用试剂 | 化学方程式 |
| FeCl2溶液 | FeCl3 | 铁粉 | Fe+2 FeCl3=3 FeCl2 |
| SiO2 | Al 2O3 | 盐酸 | Al2O3+6HCl=2Al Cl3+3 H2O |
| Fe(OH)3 | Al (OH)3 | NaOH溶液 | Al (OH)3+NaOH=Na[Ai(OH)4] |
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异及混合物分离提纯方法为解答的关键,侧重分析与应用能力的考查,注意化学方程式的书写,题目难度不大.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
6.能正确表示下列反应的离子方程式是( )
| A. | 用醋酸除去水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 足量硫酸铝与纯碱反应:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑ | |
| C. | 氯气与水反应:Cl2+H2O=2H++Cl-+ClO- | |
| D. | 向Ba(OH)2溶液中加入少量NaHSO3溶液:2HSO3-+Ba2++2OH-═BaSO3↓+SO32-+2H2O |
1.常温下的下列溶液,其中酸性最弱的是( )
| A. | pH=3的溶液 | B. | c(H+)=1×10-5mol/L的溶液 | ||
| C. | c(OH-)=1×10-12 mol/L的溶液 | D. | 0.005 mol/L的H2SO4溶液 |

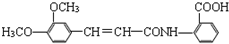 ).
).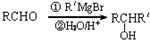
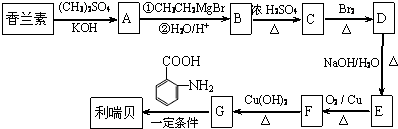
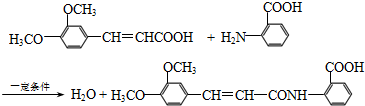
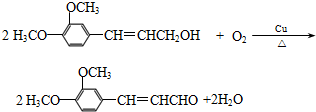
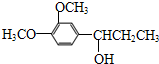 .
.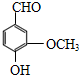 .
.


 .
. 同分异构体有4种.
同分异构体有4种. 的合成路线(用流程图表示,无机试剂任选)注:合成路线的书写格式参照如下实例:
的合成路线(用流程图表示,无机试剂任选)注:合成路线的书写格式参照如下实例: