题目内容
14.下列气体中,能使品红溶液褪色的是( )| A. | N2 | B. | CO2 | C. | SO2 | D. | CH4 |
分析 具有漂白性的物质可使品红褪色,如HClO、过氧化氢、臭氧、过氧化钠、二氧化硫以及活性炭等,以此解答该题.
解答 解:N2、CO2、CH4不能使品红溶液褪色,所以没有漂白性,二氧化硫具有漂白性,二氧化硫能使品红溶液褪色,
故选C.
点评 本题以漂白原理为载体考查了二氧化硫的性质,二氧化硫的漂白性和次氯酸的漂白原理不同,二氧化硫的漂白性是和有色物质反应生成无色物质,次氯酸的漂白性是利用次氯酸的强氧化性.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.常温下将0.1mol下列物质分别投入90g水中充分混合:①Na ②NaOH ③Na2O④Na2O2,所得溶液中OH-物质的量浓度大小排列顺序正确的是( )
| A. | ③>④>②>① | B. | ④>③>②>① | C. | ①>④=③>② | D. | ③=④>①>② |
5.下列化学式只表示一种纯净物的是( )
| A. | C2H4 | B. | C4H10 | C. | C2H4Br2 | D. | C3H6O |
2.全钒电池以惰性材料作电极,在电解质溶液中发生的电池总反应为:VO2+(蓝色)+H2O+V3+(紫色)$?_{放电}^{充电}$VO2+(黄色)+V2+(绿色)+2H+下列说法错误的( )
| A. | 充电时,反应每生成2mol H+时电子转移的物质的量为2mol | |
| B. | 放电过程中,正极附近溶液的酸性减弱 | |
| C. | 放电时,正极反应为VO2++2H++e-=VO2++H2O | |
| D. | 充电时,阳极附近溶液由蓝色逐渐变为黄色 |
9.已知苯的同系物可以被酸性KMnO4 溶液氧化,如: 现有苯的同系物,其蒸气密度为H2的60倍,该烃经氧化后,其产物1mol可中和3mol NaOH,则该烃的结构可能有( )
现有苯的同系物,其蒸气密度为H2的60倍,该烃经氧化后,其产物1mol可中和3mol NaOH,则该烃的结构可能有( )
 现有苯的同系物,其蒸气密度为H2的60倍,该烃经氧化后,其产物1mol可中和3mol NaOH,则该烃的结构可能有( )
现有苯的同系物,其蒸气密度为H2的60倍,该烃经氧化后,其产物1mol可中和3mol NaOH,则该烃的结构可能有( )| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
19.下列各组反应(表中物质均为反应物),反应刚开始时,放出H2的速率最大的是( )
| 编号 | 金属(粉末状)(mol) | 酸的浓度及体积 | 反应温度(℃) |
| A | Mg,0.1 | 6mol•L-1硝酸10mL | 60 |
| B | Mg,0.1 | 3mol•L-1盐酸10mL | 60 |
| C | Fe,0.1 | 3mol•L-1盐酸100mL | 60 |
| D | Mg,0.1 | 3mol•L-1硫酸5mL | 60 |
| A. | A | B. | B | C. | C | D. | D |
6.下表是元素周期表的一部分,针对表中的①~⑧中元素,填空回答.
(1)写出下列元素的名称②氮④钠⑥硅
(2)在这些元素中,化学性质最不活泼的原子的原子结构示意图为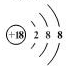 .
.
(3)③⑤⑦元素原子半径由大到小的顺序是Al>Cl>F(填元素符号).
(4)某元素三价阳离子的核外有10个电子,该元素是铝(填元素名称).
(5)④的单质与水反应的离子方程式是2Na+2H2O=2Na++2OH-+H2↑.
(6)⑦元素的单质常温下的颜色是黄绿色,用电子式表示⑦元素的氢化物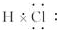 .
.
(7)写出元素⑤的氢氧化物与NaOH溶液反应的化学方程式Al(OH)3+NaOH=NaAlO2+2H2O.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(2)在这些元素中,化学性质最不活泼的原子的原子结构示意图为
 .
.(3)③⑤⑦元素原子半径由大到小的顺序是Al>Cl>F(填元素符号).
(4)某元素三价阳离子的核外有10个电子,该元素是铝(填元素名称).
(5)④的单质与水反应的离子方程式是2Na+2H2O=2Na++2OH-+H2↑.
(6)⑦元素的单质常温下的颜色是黄绿色,用电子式表示⑦元素的氢化物
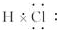 .
.(7)写出元素⑤的氢氧化物与NaOH溶液反应的化学方程式Al(OH)3+NaOH=NaAlO2+2H2O.
3.在下列条件下,可能大量共存的离子组是( )
| A. | c(H+)=1×10-14mol/L的溶液:K+、Cu2+、I-、SO42- | |
| B. | 水电离出的c(H+)=1×10-14mol/L的溶液:K+、Na+、AlO2-、S2O32- | |
| C. | 能与Al反应生成H2的溶液:NH4+、Ca2+、NO3-、I- | |
| D. | 能与K3[Fe(CN)6]产生蓝色沉淀的溶液:H+、Na+、SO42-、CrO42- |
 工业上可利用乙烯和水在催化剂、加热和加压条件下反应制备乙醇,实验室中可利用乙醇和浓硫酸(浓硫酸的作用是催化剂和脱水剂)在170℃的温度下反应制备乙烯
工业上可利用乙烯和水在催化剂、加热和加压条件下反应制备乙醇,实验室中可利用乙醇和浓硫酸(浓硫酸的作用是催化剂和脱水剂)在170℃的温度下反应制备乙烯