题目内容
4,7-二甲基香豆素(熔点:132.6℃)是一种重要的香料,广泛分布于植物界中,由间甲苯酚为原料的合成反应如下: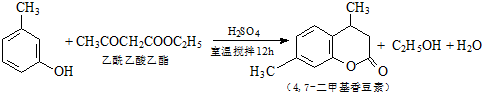
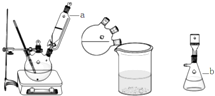
实验装置图如下:
主要实验步骤:
步骤1.向三口烧瓶中加入浓硫酸,并冷却至0℃以下,搅拌下滴入间甲苯酚30mL(0.29mol)和乙酰乙酸乙酯26.4mL (0.21mol)的混合物.
步骤2.保持在10℃下,搅拌12h,反应完全后,将其倒入冰水混合物中,然后抽滤、水洗得粗品
步骤3.粗品用乙醇溶解并重结晶,得白色针状晶体并烘干,称得产品质量为33.0g.
(1)图中仪品名称:a ,b .
(2)浓H2SO4需要冷却至0℃以下的原因是 .
(3)反应需要搅拌12h,其原因是 .
(4)确定最终产品是4,7-二甲基香豆素的实验或方法是
(5)本次实验产率为 .

实验装置图如下:

主要实验步骤:
步骤1.向三口烧瓶中加入浓硫酸,并冷却至0℃以下,搅拌下滴入间甲苯酚30mL(0.29mol)和乙酰乙酸乙酯26.4mL (0.21mol)的混合物.
步骤2.保持在10℃下,搅拌12h,反应完全后,将其倒入冰水混合物中,然后抽滤、水洗得粗品
步骤3.粗品用乙醇溶解并重结晶,得白色针状晶体并烘干,称得产品质量为33.0g.
(1)图中仪品名称:a
(2)浓H2SO4需要冷却至0℃以下的原因是
(3)反应需要搅拌12h,其原因是
(4)确定最终产品是4,7-二甲基香豆素的实验或方法是
(5)本次实验产率为
考点:制备实验方案的设计
专题:
分析:(1)根据装置图分析;
(2)浓硫酸具有强氧化性和脱水性,温度高能使有机物氧化和脱水碳化;
(3)使反应物充分接触反应,提高反应产率;
(4)4,7-二甲基香豆素熔点较低,可以测量熔点,也可以通过实验仪器;
(5)已知间甲苯酚30mL(0.29mol)、乙酰乙酸乙酯26.4mL (0.21mol),若完全反应间甲苯酚过量,按照乙酰乙酸乙酯计算求出理论产量,再求出产率.
(2)浓硫酸具有强氧化性和脱水性,温度高能使有机物氧化和脱水碳化;
(3)使反应物充分接触反应,提高反应产率;
(4)4,7-二甲基香豆素熔点较低,可以测量熔点,也可以通过实验仪器;
(5)已知间甲苯酚30mL(0.29mol)、乙酰乙酸乙酯26.4mL (0.21mol),若完全反应间甲苯酚过量,按照乙酰乙酸乙酯计算求出理论产量,再求出产率.
解答:
解:(1)由装置图分析可知a为恒压滴液漏斗,b为吸滤瓶,故答案为:恒压滴液漏斗;吸滤瓶;
(2)浓硫酸具有强氧化性和脱水性,反应温度高浓硫酸能使有机物氧化和脱水碳化,发生副反应,所以浓H2SO4需要冷却至0℃以下,
故答案为:防止浓硫酸将有机物氧化和炭化;
(3)不断的搅拌反应混合物,可以使反应物充分接触反应,从而提高反应产率,
故答案为:使反应物充分接触反应,提高反应产率;
(4)4,7-二甲基香豆素(熔点:132.6℃)熔点较低,可以测量熔点,也可以通过实验仪器测定其红外(紫外)光谱(及核磁共振氢谱)等方法来检验最终产品是4,7-二甲基香豆素;
故答案为:测量熔点或测定其红外(紫外)光谱(及核磁共振氢谱)等;
(5)已知间甲苯酚30mL(0.29mol)、乙酰乙酸乙酯26.4mL (0.21mol),若完全反应间甲苯酚过量,
按照乙酰乙酸乙酯计算理论产量为0.21mol×176g/mol=36.96g,
则产率为
×100%=89.0%,
故答案为:89.0%.
(2)浓硫酸具有强氧化性和脱水性,反应温度高浓硫酸能使有机物氧化和脱水碳化,发生副反应,所以浓H2SO4需要冷却至0℃以下,
故答案为:防止浓硫酸将有机物氧化和炭化;
(3)不断的搅拌反应混合物,可以使反应物充分接触反应,从而提高反应产率,
故答案为:使反应物充分接触反应,提高反应产率;
(4)4,7-二甲基香豆素(熔点:132.6℃)熔点较低,可以测量熔点,也可以通过实验仪器测定其红外(紫外)光谱(及核磁共振氢谱)等方法来检验最终产品是4,7-二甲基香豆素;
故答案为:测量熔点或测定其红外(紫外)光谱(及核磁共振氢谱)等;
(5)已知间甲苯酚30mL(0.29mol)、乙酰乙酸乙酯26.4mL (0.21mol),若完全反应间甲苯酚过量,
按照乙酰乙酸乙酯计算理论产量为0.21mol×176g/mol=36.96g,
则产率为
| 33.0g |
| 36.96g |
故答案为:89.0%.
点评:本题考查了有机物的制备实验,侧重于实验仪器、实验操作、产率的计算的考查,题目难度中等,考查了学生的实验探究能力.

练习册系列答案
相关题目
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、HCO3-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是( )
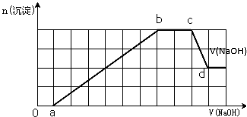

| A、原溶液中含有的Fe3+和Al3+的物质的量之比为1:1 |
| B、ab段发生的离子反应为:Al3++3OH-=Al(OH)3↓,Mg2++2OH-=Mg(OH)2↓ |
| C、原溶液中含有的阳离子必定有H+、NH4+、Al3+但不能肯定Mg2+和Fe3+的中的哪一种 |
| D、d点溶液中含有的溶质只有Na2SO4 |
中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论合理的是( )
| A、根据同周期元素的电负性变化趋势,推出Cl的电负性比S大 |
| B、根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 |
| C、根据溶液的pH与溶液酸碱性的关系,推出pH=7的溶液一定显中性 |
| D、根据强酸可以制取弱酸的规律,推出将HCl加入到AgNO3溶液中能制备HNO3 |
普罗加比对瘫痫、痉挛和运动失调均有良好的治疗效果,其结构如图所示,有关普罗加比的说法正确的是( )
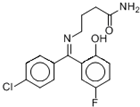

| A、该分子在1H核磁共振谱中有12个峰 |
| B、久置在空气中的普罗加比会因氧化而变质 |
| C、1 mol普罗加比最多可与3 mol NaOH反应 |
| D、一定条件下,1mol普罗加比最多能与2mol H2发生加成反应 |
 龙胆酸甲酯是制取抗心律失常药物--氟卡尼的中间体.
龙胆酸甲酯是制取抗心律失常药物--氟卡尼的中间体.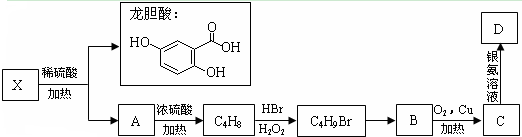
 正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一种化工原料,常温下为无色液体,不溶于水,沸点为142.4℃,密度比水小.某实验小组利用如下装置合成正丁醚(其它装置均略去),发生的主要反应为:
正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一种化工原料,常温下为无色液体,不溶于水,沸点为142.4℃,密度比水小.某实验小组利用如下装置合成正丁醚(其它装置均略去),发生的主要反应为: 为了探究“二氧化碳是否在水存在时才能和过氧化钠反应”,课题研究小组的同学们设计了如图所示的实验装置,分别进行甲、乙两次实验:
为了探究“二氧化碳是否在水存在时才能和过氧化钠反应”,课题研究小组的同学们设计了如图所示的实验装置,分别进行甲、乙两次实验: