题目内容
6.在氧化还原反应中,一种元素的化合价升高,另一种(或同一种)元素的化合价必然降低,且化合价升降的总数相等.己知A、B、C、D、E均为含氯的化合物,且在一定条件下具有如下转化关系(未配平,且部分反应物或产物已省略).已知氯元素的最低化合价为-1.①A→B+NaCl
②B+H2O→C+H2↑
③D+NaOH→A+B+H2O
④E+NaOH→B+C+H2O
则这五种化合物中氯元素的化合价由低到高的顺序是ADBEC.
分析 A、B、C、D、E均为氯的化合物,根据氧化还原反应中Cl元素的化合价升降来分析解答
解答 解:①A→B+NaCl中,NaCl中Cl元素为-1价,则Cl元素的化合价为B>A>-1,
②B+H2O→C+H2↑,H元素的化合价降低,则Cl元素的化合价升高,所以Cl元素的化合价为C>B,
③D+NaOH→A+B+H2O中,结合①可知,Cl元素的化合价为B>D>A,
④E+NaOH→B+C+H2O中,结合②可知Cl元素的化合价为C>E>B,
所以五种化合物中氯的化合价由低到高的顺序是:ADBEC.
故答案为:ADBEC.
点评 本题考查氧化还原反应,明确氧化还原反应中元素的化合价变化是解答本题的关键,题目难度不大.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案
相关题目
17.下列实验操作中正确的是( )
| A. | 用托盘天平称量物质时,加砝码的顺序是由大到小,最后移动游码 | |
| B. | 用盛有饱和Na2CO3溶液的洗气瓶除去CO2中混有的SO2 | |
| C. | 某溶液使pH试纸变成蓝色,说明该溶液是可溶性碱的水溶液 | |
| D. | 从试剂瓶中取出的药品,若使用后有剩余均不能放回原试剂瓶 |
14.常温下,下列叙述不正确的是( )
| A. | 两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1>10c2 | |
| B. | NaB溶液的pH=8,c(HB)=9.9×10-7mol•L-1 | |
| C. | 向H2SO3溶液中加入NaOH溶液至溶液恰好呈中性,此时c(Na+)>2c(SO32-) | |
| D. | 25℃时,向0.1mol•L-1的NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+) |
15.分子式为C4H10O的有机物含有-CH2OH基团的同分异构体有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
16.下列说法正确的是( )
| A. | 物质的量就是物质的数量 | |
| B. | Mg2+的摩尔质量为24g/mol | |
| C. | 标准状况下,22.4L水的物质的量为1mol | |
| D. | 80g NaOH溶于1L水中,所得溶液中NaOH的物质的量浓度为2mol/L |
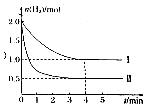 工业上可用CO2与H2反应生成甲醇,在T℃下,将1mol CO2 和2mol H2 充入5L恒容密闭容器中发生反应;CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得H2的物质的量随时间的变化情况如图中曲线Ⅰ所示.
工业上可用CO2与H2反应生成甲醇,在T℃下,将1mol CO2 和2mol H2 充入5L恒容密闭容器中发生反应;CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得H2的物质的量随时间的变化情况如图中曲线Ⅰ所示.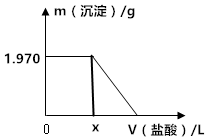 某固体混合物中含有Na2CO3、NaOH、BaCl2.现将3.940g该固体混合物溶于足量水中,结果得到1.970g沉淀;向反应后的试管中逐滴滴加0.5000mol/L的盐酸,加入盐酸的体积和沉淀质量的变化如图所示.
某固体混合物中含有Na2CO3、NaOH、BaCl2.现将3.940g该固体混合物溶于足量水中,结果得到1.970g沉淀;向反应后的试管中逐滴滴加0.5000mol/L的盐酸,加入盐酸的体积和沉淀质量的变化如图所示.