题目内容
7.某硫酸铁固体中含有少量Fe、Al2O3等杂质.要测定样品中铁元素的质量分数,现称取wg样品,按以下操作配成100mL溶液后,再按如下流程进行实验:
(1)操作A所用到的玻璃仪器除烧杯、玻璃棒外,还必须有100mL容量瓶、胶头滴管(填仪器名称).
(2)向20mL溶液中先加入H2O2的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;再加入过量烧碱溶液发生反应的离子方程式有H++OH-=H2O,Fe3++3OH-=Fe(OH)3 ↓,Al3++4OH-=AlO2-+2H2O.
(3)简述如何判断沉淀是否已经洗涤干净?取少量最后一次洗出液,滴加BaSO4溶液,若无沉淀生成,则证明洗涤干净.
(4)沉淀的灼烧过程应在坩埚(填仪器名称)中进行.若灼烧后固体质量为xg,则样品中铁元素的质量分数是$\frac{7x}{2w}$×100%.
分析 某硫酸铁固体中含有少量Fe、Al2O3等杂质,在稀硫酸和水中溶解在100ml容量瓶中配制,溶液中含铁离子、亚铁离子、铝离子、硫酸根离子等,操作B为量取20.00ml溶液,加入过氧化氢是氧化亚铁离子生成铁离子,再加入过量的氢氧化钠溶液沉淀铁离子,铝离子生成偏铝酸钠溶液,过滤得到氢氧化铁沉淀,在坩埚中灼烧得到红棕色固体为氧化铁,
(1)根据配制一定物质的量浓度的溶液所需要的仪器有:量筒、胶头滴管、烧杯、玻璃棒、一定规格的容量瓶;
(2)分析可知过氧化氢是氧化亚铁离子生成铁离子,加入过量氢氧化钠溶液是沉淀铁离子,除去铝离子;
(3)根据取少量最后一次洗出液,滴加BaSO4溶液,若无沉淀生成,则证明洗涤干净;
(4)固体灼烧在坩埚中,若灼烧后固体质量为xg,结合元素守恒计算样品中铁元素的质量分数.
解答 解:(1)因配制一定物质的量浓度的溶液所需要的仪器有:量筒、胶头滴管、烧杯、玻璃棒、一定规格的容量瓶;
故答案:100mL容量瓶、胶头滴管;
(2)分析可知过氧化氢是氧化亚铁离子生成铁离子,向20mL溶液中先加入H2O2的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,加入过量氢氧化钠溶液是沉淀铁离子,除去铝离子,再加入过量烧碱溶液发生反应的离子方程式有:H++OH-=H2O,Fe3++3OH-=Fe(OH)3 ↓,Al3++4OH-=AlO2-+2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;H++OH-=H2O,Fe3++3OH-=Fe(OH)3 ↓,Al3++4OH-=AlO2-+2H2O;
(3)最后一次洗出液中若无硫酸根离子,则已经洗涤干净,所以操作方法为:取少量最后一次洗出液,滴加BaSO4溶液,若无沉淀生成,则证明洗涤干净,
故答案为:取少量最后一次洗出液,滴加BaSO4溶液,若无沉淀生成,则证明洗涤干净;
(4)沉淀的灼烧过程应在坩埚中进行,若灼烧后固体质量为xg,则样品中铁元素的质量分数=$\frac{\frac{xg}{160g/mol}×2×56g/mol×\frac{100ml}{20ml}}{wg}$×100%=$\frac{7x}{2w}$×100%,
故答案为:坩埚;$\frac{7x}{2w}$×100%.
点评 本题主要考查了铁元素的质量分数的测定,同时考查了实验知识,主要是实验测定,滴定实验步骤分析应用,题目难度中等,掌握基础是关键.

| A. | 用托盘天平称量物质时,加砝码的顺序是由大到小,最后移动游码 | |
| B. | 用盛有饱和Na2CO3溶液的洗气瓶除去CO2中混有的SO2 | |
| C. | 某溶液使pH试纸变成蓝色,说明该溶液是可溶性碱的水溶液 | |
| D. | 从试剂瓶中取出的药品,若使用后有剩余均不能放回原试剂瓶 |
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
| A. | 银氨溶液 | B. | 金属钠 | C. | NaHCO3溶液 | D. | 酚酞溶液 |
| A. | K+、MnO4-、Na+、I- | B. | Mg2+、Na+、NO3-、CO32- | ||
| C. | AlO2-、NO3-、H+、SO42- | D. | CH3COO-、Na+、SO42-、H+、 |
| A. | 物质的量就是物质的数量 | |
| B. | Mg2+的摩尔质量为24g/mol | |
| C. | 标准状况下,22.4L水的物质的量为1mol | |
| D. | 80g NaOH溶于1L水中,所得溶液中NaOH的物质的量浓度为2mol/L |
| A. | 索尔维制碱法 | B. | 合成氨 | C. | 乙烯水化 | D. | SO2转化为SO3 |
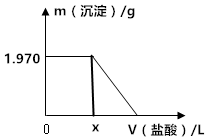 某固体混合物中含有Na2CO3、NaOH、BaCl2.现将3.940g该固体混合物溶于足量水中,结果得到1.970g沉淀;向反应后的试管中逐滴滴加0.5000mol/L的盐酸,加入盐酸的体积和沉淀质量的变化如图所示.
某固体混合物中含有Na2CO3、NaOH、BaCl2.现将3.940g该固体混合物溶于足量水中,结果得到1.970g沉淀;向反应后的试管中逐滴滴加0.5000mol/L的盐酸,加入盐酸的体积和沉淀质量的变化如图所示.